Chemia organiczna/Fluorowcopochodne węglowodorów
Spis treści
Większość związków organicznych oprócz węgla i wodoru zawiera inne pierwiastki, które w chemii organicznej nazywa się heteroatomami. Wiązania C—heteroatom są z reguły bardziej polarne aniżeli wiązanie C–H, co przyczynia się do większej reaktywności tych wiązań względem odczynników jonowych.

|
|
| tyroksyna | purpura tyryjska |
Związki tytułowe zawierają zamiast jednego lub więcej atomu wodoru w jakimkolwiek węglowodorze atom fluoru, chloru, bromu lub jodu. Pierwiastki te są w tych związkach jednowartościowe tzn. tworzą pojedyncze wiązania C–fluorowiec. Znane są związki, w których fluorowce przybierają wyższą wartościowość (aż do VII), ale nimi nie będziemy się zajmować. Mianem "fluorowiec" lub "halogen" (halogen — co z greckiego znaczy "tworzący sól") określa się w chemii pierwiastki z grupy VIIa układu okresowego (oprócz już wymienionych — jeszcze astat). Ogólnie tę klasę związków określa się jako halogenowęglowodory, fluorowcowęglowodory lub opisowo jako fluorowcowe (halogenowe) pochodne węglowodorów. Kolokwialnie nieraz stosuje się również określenie chlorowcopochodne albo chlorowcozwiązki. Używa się często też pojęcia halogenki węglowodorów, np. halogenki alkilowe (pochodne fluorowcowe węglowodorów alifatycznych), halogenki alkenylowe (pochodne fluorowcowe alkenów) itd.
Naturalne związki organiczne zawierające halogeny występują w niewielkich ilościach w organizmach roślinnych i zwierzęcych, głównie morskich. Dwa wybrane przykłady naturalnych związków zawierających fluorowce (i inne grupy funkcyjne, o których będziemy mówili później) pokazuje Rys. Figure 1. Nowsze badania wykazują, że niektóre z halogenopochodnych organicznych mogą pojawiać się w znaczących ilościach, np. CH3Cl, w wyniku pożarów lasów, wybuchów wulkanicznych i jako produkty metabolizmu brunatnic morskich i innych niższych organizmów. Duże znaczenie mają one również w przemyśle
chemicznym jako reagenty do otrzymywania innych związków: polimerów (polichlorek winylu — synonimy: winidur, igelit, PCV lub PCW), leków, środków ochrony roślin, czynników chłodzących (freony — obecnie wychodzące z użycia — patrz niżej), środków gaśniczych (gaśnice halogenowe). Stwierdzono jednak, że związki te jakkolwiek wykazują dobre parametry techniczne, stanowią często problem ekologiczny, gdyż jako związki nienaturalne bardzo wolno ulegają biodegradacji i zanieczyszczają atmosferę, wodę i glebę na Ziemi. Mogą w efekcie stanowić zagrożenie dla ludzi i przyrody, jak np. dziura ozonowa spowodowana przedostawaniem się freonów do górnych warstw atmosfery.
Nomenklatura i właściwości fizyczne fluorowcowych pochodnych węglowodorów.
Systematyczne zasady nazywania związków z atomami fluorowców są takie same jak odpowiednich węglowodorów. Obecność heteroatomów zaznacza się w przedrostku jako fluoro-, chloro-, bromo- lub jodo- z odpowiednim lokantem wskazującym numer kolejny atomu węgla związanego z fluorowcem. W przypadku obecności różnych podstawników wymienia się je alfabetycznie, ale zawsze przed przedrostkami określającymi grupy alkilowe.
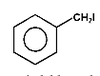
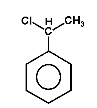
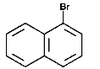
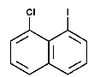
Na Rys. Figure 2. podano kilka przykładów nazw organicznych związków fluorowców (w nawiasach podano nazwy zwyczajowe, stosowane równie często jak systematyczne).
Właściwości fizyczne wybranych związków z tej klasy zebrane są poniżej w Tabeli Figure 3. Na ogół są to związki ciekłe (z wyjątkiem pierwszych członów szeregów homologicznych, które są gazami w temp. pokojowej, oraz związków o bardziej rozbudowanej strukturze, które są ciałami stałymi, np. CHI3), nierozpuszczalne w wodzie. Należy zwrócić uwagę na budowę dipolową halogenopochodnych węglowodorów. Wiąże się to ściśle z obecnością silnie spolaryzowanych wiązań w cząsteczkach tych związków.
| Związek | T. wrz., °C | T. topn., °C | Gęstość, g/cm3 | M. dipolowy, D |
|---|---|---|---|---|
| CH3Cl | -23,7 | -97,6 | ||
| CH2Cl2 | 40,1 | -96,7 | 1,34 | 1,55 |
| CHCl3 | 61,3 | -63,5 | 1,50 | 1,15 |
| CCl4 | 76,0 | -22,8 | 1,63 | 0 |
| CH3Br | 4,6 | -93,0 | 1,73 | 1,78 |
| CH3I | 42,5 | -66,1 | 2,28 | 1,64 |
| C6H5Cl | 132,0 | -45,0 | 1,11 | 1,56 |
| C6H5Br | 156,0 | -30,6 | 1,50 | 1,53 |
| C6H5l | 188,6 | -31,4 | 1,83 | 1,25 |
| CH2=CH—CH2Br | 71,3 | -119,4 | 1,40 | 1,79 |
Atom fluorowca odznaczający się dużą elektroujemnością stanowi biegun ujemny dipolu (ściąga na siebie elektrony; w chemii organicznej mówimy, że wywiera ujemny efekt indukcyjny). W wyniku działania tego efektu atom węgla związany z fluorowcem obdarzony jest cząstkowym ładunkiem dodatnim, a efekt ten przenoszony jest na dalsze wiązania (atomy), chociaż ze słabnącą wraz z odległością siłą.
Halogenki alkilowe.
Właściwości chemiczne pochodnych fluorowcowych zależą silnie od budowy danego związku. Na ogół omawianie chemii tych związków ogranicza się do poznania rekcji pochodnych alkanów, czyli halogenków alkilowych. Tym niemniej do reaktywności różnych pochodnych fluorowcowych wrócimy jeszcze.
Substytucja nukleofilowa w halogenkach alkilowych.
Najbardziej znanym zastosowaniem syntetycznym halogenków alkilowych są reakcje substytucji, które przebiegają z rozerwaniem wiązania C—fluorowiec i powstaniem nowego wiązania C—inny heteroatom bądź C—C. Możliwości syntez tego typu pokazuje poniżej Rys. Figure 4.
R—X + CN- → R—CN + X- synteza nitryli
R—X + HS- → R—SH + X- synteza tioli
R—X + OH- → R—OH + X- synteza alkoholi
R—X + HC≡C- → R—C≡CH + X- synteza alkinów
Figure 4: Przykłady wykorzystania reakcji substytucji w halogenkach alkilowych
(R — grupa alkilowa, X — atom fluorowca, najczęściej Cl lub Br) do syntezy innych klas związków organicznych.Jak łatwo zauważyć na powyższym Rys. Figure 4. reagentami powodującymi rozerwanie wiązania C-X są cząstki o charakterze elektroujemnym (aniony, bądź w przypadku amoniaku zasadowa cząsteczka, której zasadowość wynika z obecności wolnej pary elektronowej na atomie azotu). Takie elektroujemne reagenty nazywamy w chemii odczynnikami nukleofilowymi (nukleofilami, por. pojęcie odczynnika elektrofilowego omówione w Rozdz. o alkenach i węglowodorach aromatycznych).
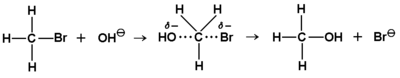
Dokładne badania kinetyki reakcji podstawienia w halogenkach alkilowych pokazały, że w zależności od budowy substratu reakcja może następować według dwu różnych mechanizmów. Jeden z nich pokazany jest na Rys. Figure 5.
Schemat ten należy rozumieć w ten sposób, że atakujący nukleofil (w pokazanym przykładzie jon OH-) zbliża się do atomu węgla od strony przeciwnej w stosunku do położenia atomu halogenu (w tym przypadku bromu). Kierunek tego ataku staje się zrozumiały, gdy uwzględnimy fakt silnej polaryzacji wiązania C—Br, wynikającej z dużej elektroujemności halogenu i powodującej wytworzenie się na atomie węgla cząstkowego ładunku dodatniego. Atak od tej samej strony co wiązanie C—Br jest utrudniony z powodu elektrostatycznego odpychania się atomu bromu, obdarzonego cząstkowym ładunkiem ujemnym, z elektroujemnym nukleofilem. Taki mechanizm reakcji nazywamy substytucją nuklofilową drugiego rzędu (drugorzędową, dwucząsteczkową) i oznaczamy skrótem [math]S_N2[/math]. Rzędowość w tym przypadku jest pojęciem kinetycznym i oznacza zależność prędkości reakcji od stężenia obu substratów (równanie kwadratowe). Należy też dodać, że reakcja [math]S_N2[/math] przebiega jednoetapowo. Stan pośredni pokazany jest na Rys. Figure 5.
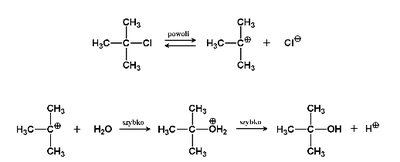
W niektórych przypadkach stwierdzono jednak, że szybkość reakcji nie zależy od stężenia odczynnika nukleofilowego. W takich reakcjach mamy do czynienia z innym mechanizmem ich przebiegu, określanym symbolem [math]S_N1[/math] i nazywanym substytucją nukleofilową pierwszego rzędu (jednocząsteczkową, pierwszorzędową). Mechanizm [math]S_N1[/math] pokazany jest na Schemacie Figure 6.
Łatwo zauważyć, że reakcja [math]S_N1[/math] przebiega dwuetapowo. W pierwszym etapie następuje dysocjacja wiązania alkil-halogen, a w drugim etapie powstały karbokation atakuje drugi substrat o charakterze nukleofilowym. Pod względem kinetycznym o całkowitej szybkości reakcji decyduje etap najwolniejszy, a więc w tym przypadku, tak jak to zaznaczono na Rys. Figure 6. etap dysocjacji wiązania alkil-chlor, dlatego szybkość reakcji nie zależy od stężenia drugiego substratu (w podanym przykładzie — H2O).
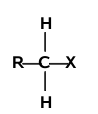
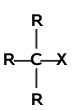
Mechanizm reakcji substytucji w halogenkach alkilowych zależy głównie od rzędowości atomu węgla związanego z halogenem. Analogicznie jak w alkanach występują halogenki alkilowe o różnej rzędowości:
|
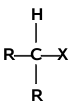
|
|
| halogenek pierwszorzędowy | halogenek drugorzędowy | halogenek trzeciorzędowy |
Halogenki pierwszorzędowe reagują według mechanizmu [math]S_N2[/math]. Mechanizm [math]S_N1[/math] jest charakterystyczny dla halogenków trzeciorzędowych. Halogenki drugorzędowe mogą reagować według obu mechanizmów, a który z nich przeważa zależy od budowy samego halogenku (tzn. od budowy podstawników R i od rodzaju atomu halogenu), od natury odczynnika nukleofilowego oraz od warunków reakcji (rozpuszczalnika, temperatury itd.).
Reakcje eliminacji w halogenkach alkilowych.
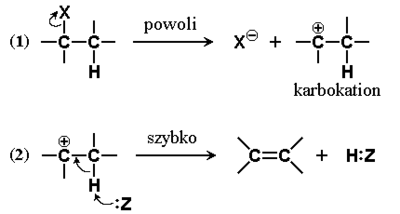
Karbokation przedstawiony na Rys. Figure 6 w poprzednim podrozdziale, dążąc do uzyskania bardziej trwałego układu, może ulegać również innemu przegrupowaniu, pokazanemu na Rys. Figure 7. Elektron wiązania C—H przy sąsiednim atomie węgla jest przechwytywany, jednocześnie zmienia się hybrydyzacja przy tym sąsiednim atomie węgla na sp2 i tworzy się wiązanie podwójne C=C. Rola odczynnika nukleofilowego (:Z) polega na ułatwieniu oderwania atomu wodoru w postaci protonu. Taką reakcję, w której od dwu sąsiednich atomów węgla z substratu usuwane są jednocześnie dwa podstawniki (atomy bądź grupy atomów) z utworzeniem wiązania wielokrotnego nazywamy [math]\beta[/math]-eliminacją[1]
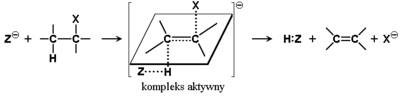
Analogicznie jak w przypadku reakcji substytucji w halogenkach alkilowych, reakcje eliminacji mogą przebiegać według dwu różnych mechanizmów. Na Rys. Figure 7. przedstawiony został mechanizm E1 czyli reakcji eliminacji pierwszego rzędu (jednocząsteczkowej), w której szybkość reakcji jest niezależna od stężenia drugiego substratu (odczynnika nukleofilowego). Alternatywny mechanizm, reakcji eliminacji drugiego rzędu (dwucząsteczkowej, E2) podany jest na Rys. Figure 8. Szybkość reakcji następującej według mechanizmu E2 zależy od stężenia obu reagentów i jest to reakcja jednoetapowa. Stan pośredni (synonim — kompleks aktywny) reakcji E2 ma określoną budowę przestrzenną.
Linie kropkowane na Rys. Figure 8. oznaczają tworzące się wiązania Z—H i [math]\pi[/math] pomiędzy atomami węgla oraz pękające wiązania C—H i C—X. Wszystkie te cztery cząstkowe wiązania leżą w jednej płaszczyźnie, która jest prostopadła do płaszczyzny wyznaczonej przez reagujące atomy węgla i pozostałe wiązania w nowo tworzącym się układzie alkenu. Grupy odchodzące (w tym przypadku H i X) muszą znajdować się w układzie trans czyli po przeciwnych stronach zaznaczonej płaszczyzny.
W przypadku substratów niesymetrycznych o kierunku reakcji eliminacji mówi reguła Zajcewa. Tak jak wskazuje przykład podany na Rys. Figure 9. w przewadze tworzy się alken bardziej rozgałęziony (większa liczba podstawników przy atomach węgla uczestniczących w tworzeniu wiązania podwójnego).
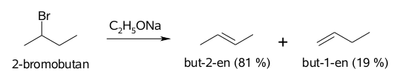
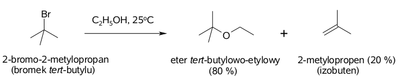
Z uwagi na niewielkie różnice w energii aktywacji w reakcjach substytucji i eliminacji halogenków alkilowych, te reakcje zawsze konkurują ze sobą. Stanowi to pewien problem, zarówno teoretyczny co do przewidywania kierunku reakcji, jak i praktyczny co do czystości produktów reakcji. Wybrany przykład pokazany jest na Rys. Figure 10.
Różna reaktywność pochodnych halogenowych.
Jak to było już wspomniane, wiązanie C—fluorowiec jest silnie spolaryzowane. Konsekwencją chemiczną tego faktu jest większa podatność na rozerwanie takiego wiązania w porównaniu ze zwykłym wiązaniem C—H. Wiąże się to ściśle ze zwiększoną reaktywnością halogenopochodnych organicznych, w szczególności wobec odczynników jonowych. W zależności jednak od budowy pojawiają się duże różnice w reaktywności poszczególnych związków. I tak, porównanie reaktywności w szeregu różnych halogenków alkilowych podaje poniższe zestawienie:
| mniejsza reaktywność → większa reaktywność | |
|---|---|
| RF < RCl < RBr < RI | zależność od rodzaju fluorowca |
| RCH2C < R2CHCl < R3Cl | zależność od rzędowości |
| CCl4 ≤ CHCl3 ≤ CH2Cl2 ≤ CH3Cl | zależność od liczby atomów fluorowca przy tym samym atomie węgla |
Ponadto zasadnicze różnice w reaktywności występują w zależności od położenia atomu fluorowca względem wiązania wielokrotnego. I tak znana jest bardzo mała podatność na rozerwanie wiązania C—fluorowiec, jeśli halogen związany jest z węglem uczestniczącym w takim wiązaniu. Mówi się w takim przypadku o bierności fluorowca w układzie winylowym, etynylowym bądź aromatycznym:
- R(H)2 C=CHCl, R(H)C≡CCl, Ar—Cl — niereaktywne
Jeśli natomiast atom fluorowca związany jest z atomem węgla sąsiednim do wiązania wielokrotnego, to wykazuje on bardzo dużą podatność na oderwanie od układu. W takim przypadku mówi się więc o ruchliwym fluorowcu w układzie allilowym, propargilowym bądź benzylowym:
- R(H)2C=CH—CH2Cl, R(H)C≡C—CH2Cl, Ar—CH2Cl — bardzo reaktywne
Halogeny w pierścieniu aromatycznym.
Chloro- i bromopochodne węglowodorów aromatycznych można otrzymywać bezpośrednio z odpowiednich węglowodorów w wyniku reakcji substytucji elektrofilowej (patrz Schematy typowych reakcji w benzenie i substytucji elektrofilowej w toluenie) działając chlorem lub bromem w obecności katalizatora, FeCl3 lub AlCl3 w przypadku chlorowania oraz FeBr3 lub AlBr3 w reakcji bromowania. Znane są również metody wprowadzania atomów fluorowców do pierścieni aromatycznych w sposób pośredni, niektóre z nich poznamy w dalszym toku wykładu.
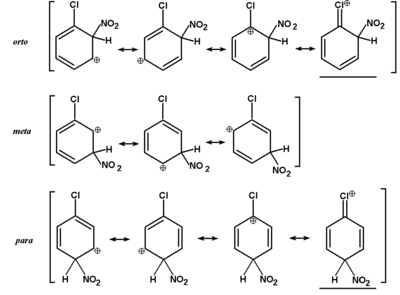
O małej reaktywności wiązania C—Cl i C—Br w układzie aromatycznym była mowa powyżej. W tym podrozdziale zastanowimy się nad tym jak obecność tych podstawników wpływa na podatność pierścienia aromatycznego na dalsze reakcje substytucji elektrofilowego. Fakty wskazują, że atomy fluorowców powodują słabą dezaktywację pierścienia (np. chlorobenzen podczas substytucji elektrofilowej reaguje ok. 30 razy wolniej niż sam benzen), a podstawienie następuje głównie w pozycje para i orto. Pierwszy z tych faktów tłumaczy się ujemnym efektem indukcyjnym fluorowców, który powoduje zmniejszenie gęstości elektronowej aromatycznego wiązania [math]\pi[/math], co tym samym utrudnia atak odczynnika elektrofilowego. Drugi z tych faktów tłumaczy się obniżeniem energii wewnętrznej w stanie pośrednim (niższa energia aktywacji powstawania kompleksu [math]\sigma[/math] — mechanizm reakcji substytucji w benzenie i profil energetyczny substytucji elektrofilowej w układzie aromatycznym.) wskutek stabilizacji mezomerycznej tego stanu w przypadku ataku na pozycje orto i para. Struktury graniczne kompleksów [math]\sigma[/math] w reakcji nitrowania chlorobenzenu pokazane są poniżej na Rys. Figure 11. Należy zwrócić uwagę na struktury podkreślone, które obrazują najniższy stan energetyczny kompleksu. W przypadku ataku na pozycję meta kompleks przejściowy takiej struktury granicznej nie może osiągnąć. Innymi słowy, podstawienie w pozycji meta wymaga znacznie większej energii aktywacji, co w praktyce oznacza tworzenie się tylko znikomych ilości produktu meta-podstawionego.
- ↑ W niektórych układach chemicznych możliwe są także reakcje [math]\alpha[/math]-eliminacji, gdy odrywane są dwa podstawniki od tego samego atomu węgla. O reakcjach [math]\alpha[/math]-eliminacji będziemy wspominać tylko sporadycznie.