Histologia/Wstęp
Wstęp
Histologia jest nauką o rozwoju, budowie i funkcjach tkanek. Jest mikroskopową częścią anatomii. Obejmuje ona także naukę o budowie i czynnościach komórki, a zatem cytologię. W przypadku tkanek chorych nosi nazwę histopatologia. Mikroskopowe badanie chorej tkanki, jest ważnym narzędziem w patologii anatomicznej, gdyż dokładne rozpoznanie raka i wielu innych chorób zwykle wymaga badania histopatologicznego próbek.
Wyróżniamy:
- histologię ogólną czyli naukę o ogólnej budowie i funkcjach wszystkich podstawowych tkanek organizmu,
- histologię szczegółową czyli naukę o mikroskopowej budowie narządów oraz układów narządów,
- histofizjologię czyli naukę o czynnościach tkanek (w powiązaniu z ich strukturą),
- histochemię czyli naukę o metodach wybarwiania i wykrywania substancji chemicznych zawartych w tkankach (stosuje się metody nie uszkadzające struktury badanego obiektu),
- histopatologię czyli naukę o budowie i funkcjach tkanek organizmu w stanie chorobowym.
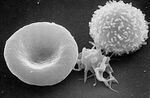
Człowiek składa się z przeszło 100 bilionów komórek różniących się pełnioną funkcją oraz budową. Komórki wyspecjalizowane w pełnieniu określonej funkcji tworzą zespoły zajmujące wspólny obszar w ciele zwany tkanką. W przypadku, gdy wszystkie komórki mają taką samą budowę, utworzona z nich tkanka jest tkanką prostą (np. tkanka tłuszczowa). Gdy tkanka złożona jest z wielu różnych komórek i substancji pozakomórkowej, mówimy o tkance złożonej. (np. tkanka nerwowa złożona z komórek nerwowych, podporowych, immunologicznych i nabłonkowych).
Kilka tkanek zajmujących wspólne terytorium i pełniących skoordynowane funkcje tworzy narząd (np. serce, żołądek, oko). Do wykonywania złożonych czynności, takich jak np. oddychanie czy odżywianie nie wystarczy jeden narząd, ale potrzebny jest układ narządów (np. układ oddechowy, układ krwionośny).
Uwzględniając cechy morfologiczne i fizjologiczne zespołów komórkowych tworzących tkanki, wszystkie tkanki dzieli się na cztery grupy
- Tkankę nabłonkową (komórki wyścielające jamy ciała, pokrywające powierzchnie a także tworzące gruczoły),
- tkankę łączną i podporową (komórki które wytwarzają substancję pozakomórkową mającą za zadanie spajać różne typy innych tkanek i zapewniać podporę narządom),
- tkankę mięśniową (komórki posiadające zdolność kurczenia się),
- tkankę nerwową (komórki budujące nerwy, rdzeń kręgowy, mózg).
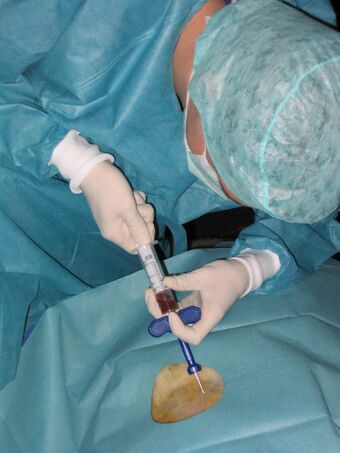
Obecnie istnieje wiele szybkich oraz bezpiecznych możliwości pobierania materiału biologicznego. W przypadku tkanek, które są bardzo łatwo dostępne, takich jak skóra, tkankę pobiera się za pomocą skalpela. Natomiast biopsja — rodzaj zabiegu diagnostycznego, będącego inwazyjną metodą pobrania materiału biologicznego z przypuszczalnie zmienionych chorobowo tkanek — ma zastosowanie w odniesieniu do narządów o trudniejszym dostępie (np. mózg, oko, tarczyca, węzeł chłonny, pierś, płuca, wątroba, kości, szpik kostny).
Wśród metod biopsyjnych wyróżniamy między innymi
- Biopsję wycinkową — fragmenty tkanki pobierane są chirurgicznie.
- Biopsję aspiracyjną cienkoigłową (BAC lub punkcja) — w której próbka komórek pobierana jest za pomocą cienkiej igły wprowadzonej do tkanki. Tkanka wprowadzana jest do strzykawki za pomocą przyłożonego podciśnienia (pociągnięciu tłoka). Ten rodzaj biopsji dostarcza tylko niewielką liczbę komórek do badania. W przypadku wykrycia komórek nowotworowych pobranego materiału jest zbyt mało, aby można było określić jaki dokładnie charakter ma wykryta zmiana. Biopsję cienkoigłową stosuje się do ustalenia rozpoznania wyczuwalnych i niewyczuwalnych guzów.
- Biopsję gruboigłową (oligobiopsja) — w której za pomocą grubej igły (średnica powyżej 1,2 mm!) pobierany jest cylindryczny wycinek tkanki. Stosuje się ją często w przypadku, gdy biopsja cienkoigłowa dała wynik niejednoznaczny.
- Biopsję wiertarkową — stosowaną najczęściej w diagnostyce kości. Zamiast igły stosuje się trepany, które wprowadza się w szybki ruch obrotowy za pomocą silnika elektrycznego. Uzyskany materiał jest większy niż w biopsji gruboigłowej i ma kształt walca.
Znajomość histologii a zatem prawidłowej budowy tkanek jest istotna, ponieważ pozwala na na rozpoznanie struktur, które zmienione są chorobowo, a także umożliwia zrozumienie w jaki sposób nieprawidłowości na poziomie fizjologicznym i biochemicznym prowadzą do rozwoju chorób. W kolejnych rozdziałach omówione zostaną szczegółowo cechy oraz funkcje wszystkich tkanek ludzkich, a także technika przygotowania materiału do badań mikroskopowych.
Technika histologiczna oraz mikroskopia
Technika histologiczna: utrwalanie i barwienie tkanek
Aby tkanki mogły być oglądane pod mikroskopem, muszą być najpierw odpowiednio utrwalone. Pełna procedura wykonania preparatu od chwili pobrania wycinka struktury a do momentu zamknięcia go szkiełkiem nakrywkowym trwa od kilku dni (w przypadku standardowych barwień przeglądowych), aż do kilku miesięcy (np. impregnacja tkanki nerwowej). Odpowiednio przechowywane preparaty (w miejscach, które są ciemne, chłodne i suche) potrafią zachować odpowiednie barwy przez dziesiątki lat.
Wydzielone skrawki (od 0,1 do 10 mikrometrów), utrwalane są chemicznie przez zanurzenie w płynie zwanym utrwalaczem (np. formalina lub etanol) lub fizycznie (za pomocą mikrofal). Pobrany wycinek narządu trafia do płynu utrwalającego, aby zapobiec wystąpieniu komórkowych zmian nekrotycznych i degeneracyjnych. Nekroza jest stopniową degradacją struktur komórkowych (m.in. denaturacją białek), obrzmieniem cytoplazmy, dezintegracją błony komórkowej i chaotyczną inaktywacją wszystkich szlaków biochemicznych, a także następuje pęcznieniem komórki (na skutek dostawania się wody do komórki) lub przeciwnie jej obkurczenie. Towarzyszy jej wydostanie się zawartości komórki (następuje rozpad komórki) do otaczającej ją przestrzeni międzykomórkowej, na skutek utraty ciągłości błony komórkowej.
Badany materiał należy niezwłocznie umieścić w utrwalaczu (aby nie dopuścić nawet do minimalnego wysuszenia). Standardowym utrwalaczem dla tkanek jest 4% roztwór wodny aldehydu mrówkowego zbuforowany do pH = 7.2 (czyli 10% zbuforowana formalina), a materiału cytologicznego 70% roztwór alkoholu etylowego. Szybkość penetracji 10% formaliny w tkance wynosi około 4 mm/dobę. Ilość utrwalacza w naczyniu musi kilkukrotnie (5-8 razy) przewyższać objętość nadsyłanego materiału, ponieważ utrwalacz zużywa się podczas utrwalania. Następnie tkanka jest odwadniana w alkoholu aż woda zostanie całkowicie usunięta a tkanka zostanie całkowicie przepojona alkoholem. W kolejnym kroku alkohol zastępuje się organicznym rozpuszczalnikiem, mieszającym się zarówno z alkoholem jak i parafiną. Na tym etapie tkanka zostaje zatapiana w parafinie, która przepaja całą tkankę. Ponieważ odbywa się to w temperaturze parafiny nieco powyżej jej punktu topnienia, gdy temperatura parafiny obniża się do temperatury pokojowej (16 stopni), parafina krzepnie dzięki czemu tkanka staje się twarda. Możliwe jest wtedy pokrojenie tkanki na mikrotomie, a następnie umieszczenie jej pomiędzy szkiełkami.
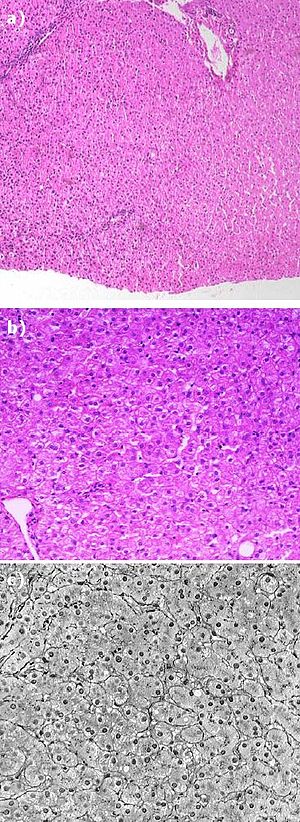
Obraz mikroskopowy żywej tkanki jest bardzo mało kontrastowy (w rzeczywistości komórki są bezbarwne), co jest spowodowane minimalnym załamaniem światła prze poszczególne tkanki i komórki. Aby uzyskać większy kontrast pozwalający na obserwacje poszczególnych części składowych zarówno tkanek jak i komórek, stosuje się odpowiednie metody barwienia. Barwienie odbywać się może poprzez chemiczne wiązanie barwienia ze strukturami tkankowymi czy absorpcji barwnika na powierzchni struktur.
Najważniejszą techniką jest barwienie hematoksyliną i eozyną (H+E). Jest to tzw. topograficzne barwienie przeglądowe, pozwalające ocenić całość struktury tkanki, poprzez kontrastowe zabarwienie cytoplazmy i jader komórkowych. Hematoksylina jest substancją zasadową, która barwi jądra komórkowe na kolor fioletowy/niebieski. Eozyna to kwaśna pochodna fluoresceiny. Najczęściej stosuje się żółtawą eozynę Y barwiąca cytoplazmę na różowo/czerwono. Kolory zabarwionej struktury:
- jądro — niebiesko-granatowe,
- cytoplazma — bladoróżowa,
- włókna retikulinowe i błony podstawne — bladoróżowe lub bezbarwne,
- włókna kolagenowe — ciemnoróżowe,
- włókna elastynowe — bladoróżowe,
- substancja międzykomórkowa w chrząstce szklistej — bladoróżowe,
- śluz — bladoróżowy,
- sarkoplazma — różowoczerwona,
- włókna nerwowe — bladoróżowe,
- włókna glejowe — bladoróżowe,
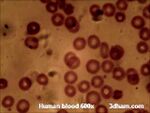
- krwinki czerwone — ceglastoczerwone,
- włóknik — ciemnoróżowy.
Po zabarwieniu preparat należy zabezpieczyć przed niekorzystnym wpływem otoczenia (uszkodzeniem mechanicznym, wysychaniem, utlenianiem niektórych barwników). Do tego celu służy tzw. zamykanie preparatów, czyli umieszczenie ich pomiędzy szkiełkiem podstawowym a nakrywkowym i wypełnienie przestrzeni pomiędzy szkiełkami substancją. Substancja ta powinna spełniać dwa następujące warunki:
- powinna posiadać taki sam współczynnik załamania światła jak szkło (w celu uniknięcia uginania i rozpraszania promieni świetlnych),
- w temperaturze pokojowej powinna hermetycznie i trwale spajać szkiełka.
Istnieją też inne specyficzne techniki barwienia poszczególnych rodzajów tkanek i komórek. Techniki impregnacji solami srebra czy złota pozwalają między innymi na wizualizację włókien nerwowych.
Inne metody barwienia
- Barwienie van Giesona — metoda wykorzystująca kwas pikrynowy i kwaśną fuksynę. Metoda ta barwi jądra na kolor bordowo-czarny lub czarny, kolagen (tkanka łączna włóknista) na kolor różowy lub bordowy natomiast mięśnie, cytoplazmę, i fibryny (białko proste zbudowane wyłącznie z aminokwasów) na żółto.
- Barwienie srebrem — azotan srebra stosowany jest głównie do barwienia DNA oraz białek (kolagenu typu II). W odpowiednich warunkach azotan srebra redukowany jest do czarnych strąków metalicznego srebra. Zredukowane srebro przybiera kolor brązowy, stąd też w miejscach związania srebra z DNA uwidaczniają się brązowe prążki. Metoda ta może być nieznacznie modyfikowana w sytuacjach, kiedy wybarwiane są różne związki (choć schemat jest niezmienny). Etapy barwienia:
- utrwalenie — odwodnienie żelu (w celu zwiększenia jego reaktywności na działanie kolejnych odczynników) i utrwalenie helisy DNA (zabezpiecza przed jego uszkodzeniem w dalszych etapach). Stosuje się tu roztwory odwadniające (np. etanol oraz metanol),
- przeprowadzenie reakcji utleniania DNA kwasem azotowym (w celu łatwiejszego wiązania się DNA z barwnikiem),
- za pomocą formaldehydu redukcja barwnika (rozpuszczalna sól azotanu srebra) do formy metalicznej — zredukowane do formy metalicznej srebro wiąże się z DNA, tworząc nierozpuszczalne sole,
- opłukanie żelu z pozostałości niezwiązanego srebra (które podczas wywoływania daje silne tło),
- wywołanie — dalsza redukcja srebra formaldehydem, węglanem sodowym lub tiosiarczanem sodu. Ponieważ zredukowane srebro przybiera kolor brązowy, w miejscach związania srebra z DNA uwidaczniają się brązowe prążki,
- zatrzymanie proces redukcji przy jednoczesnym utrwaleniu reakcji barwnej (stosując np. kwas octowy obniżamy pH roztworu).
- Barwienie PAS — metoda ta jest stosowana do wykrywania glikogenu (węglowodanu typowego) w tkankach takich jak wątroba, serce i mięśnie szkieletowe. Metoda stosowana często do uwidoczniana błony podstawnej. Kolory zabarwionej struktury:
- jądro — niebieskie,
- cytoplazma — bladoróżowa lub bezbarwna,
- włókna retikulinowe i błony podstawne — bladoniebieskie do bezbarwnych,
- włókna kolagenowe — bladoniebieskie do bezbarwnych,
- włókna elastynowe — bladoniebieskie do bezbarwnych,
- substancja międzykomórkowa w chrząstce szklistej — czerwonoróżowa,
- śluz — czerwonoróżowy,
- sarkoplazma — bladofioletowa,
- włókna nerwowe — bladofioletowe,
- włókna glejowe — bladofioletowe,
- krwinki czerwone — jasnoczerwone,
- włóknik — różowy.
- Barwienie May-Grunwald-Giemsa — stosowane jest najczęściej do barwienia szpiku kostnego i rozmazów krwi.
- Barwienie przyżyciowe — w mikroskopii świetlnej próbki mogą być umieszczane w kropli wody, nakryte szkiełkiem nakrywkowym i bezpośrednio oglądane pod mikroskopem. Taki preparat nazywany jest przyżyciowym. Umożliwia badanie struktury żywych komórek a także obserwację dynamicznych procesów które w nich zachodzą (unikając zaburzeń spowodowanych śmiercią komórek i procesami, które po niej następują). Jest to barwienie żywych komórek i tkanek barwnikami o bardzo małych stężeniach (1:10000 - 1:100000), które nie są dla nich toksyczne (np. barwienie czerwienią obojętną, zielenią janusową, błękitem metylenowym, karminem, saponiną). Barwniki te, obdarzone ładunkiem dodatnim, wiążą się do ładunków ujemnych na składnikach komórkowych. Następuje odróżnienie komórek żywych od martwych, które się zabarwiają (barwnik jest pochłaniany tylko przez komórki żywe).
Należy pamiętać, że PREPARAT HISTOLOGICZNY POKAZUJE jedynie OBRAZ STATECZNY, Z MOMENTU JEGO UTRWALENIA. W ŻYWEJ TKANCE natomiast PROCESY SĄ DYNAMICZNE. Ponadto, warto zauważyć, że preparaty są tylko wycinkiem dużego narządu, w którym struktury nie będąc rozmieszczone równomiernie, mogą nie pojawić się w każdym skrawku. Ponadto obecna technika histologiczna nie pozwala na uniknięcie powstawania artefaktów. Podczas przygotowywania preparatów zmienia się wielkość, kształt i skład chemiczny składników tkankowych. Rozpuszczalniki organiczne wypłukują tłuszcze obojętne (odkładane w cytoplazmie), natomiast roztwory wodne — glikogen (wielocukier gromadzony w wątrobie i tkance mięśniowej).
Ćwiczenia. Mikroskop optyczny
Obserwacja tkanek wykonywana będzie za pomocą mikroskopu optycznego Bresser Biolux LCD wyposażonego w 3,5" (8,9cm) wyświetlacz LCD, umożliwiający zachowywanie obrazu preparatów oraz nagrania filmów. Wewnętrzna pamięć oraz dodatkowe gniazdo czytnika kart pamięci SD pozwalają na rejestrację oraz proste przenoszenie zapamiętanych obrazów i filmów. Mikroskop pozwala na wykonywanie zdjęć pojedynczych lub seryjnych (co 5 sekund). Trzy obiektywy (4x, 10x i 40x) w połączeniu matrycą o rozdzielczości 3 mln pikseli (typu CMOS) pozwalają uzyskać powiększenia 40x, 100x i 400x (współczynnik powiększenia okularu LCD wynosi 10x). Ponadto, czterokrotny zoom cyfrowy umożliwia uzyskanie powiększenia 1600x. Maksymalna rozdzielczość uzyskiwanych zdjęć: 2048 x 1536 (inne dostępne rozdzielczości zdjęć: 640x480, 800x600, 1024x768, 1280x960, 1600x1200, 2048x1536).

Mikroskop wyposażony jest w oświetlenie diodowe LED (230 V) oraz regulację natężenia dla oświetlenia górnego i dolnego. Przełącznik wyboru rodzaju oświetlenia umożliwia badanie w świetle:
- przechodzącym — możemy obserwować przedmioty przezroczyste. Podczas takiej obserwacji światło pada od dołu przechodząc przez preparat na stoliku mikroskopu, zostaje następnie powiększone przez soczewki obiektywu i matrycę okularu, a następnie dostaje się do naszego oka; wiele mikroorganizmów żyjących w wodzie, części roślin i najmniejszych części organizmów zwierzęcych charakteryzuje się naturalną przejrzystością, inne wymagają jednak specjalnego spreparowania,
- odbitym — podczas takiej obserwacji światło pada na obserwowany przedmiot, zostaje od niego odbite i następnie dostaje się poprzez soczewkę do oka; gdy obserwujesz nie barwione obiekty lub roztwory; zwykle przedmioty nieprzezroczyste, np. mniejsze zwierzęta, części roślin, tkanek itd.,
- jednoczesny wybór obu rodzajów oświetlenia — używanie obu rodzajów oświetlenia jest wskazane podczas badania semi-kolorowych preparatów. Ten tryb nie jest zalecany dla przepuszczających światło obiektów na szkiełkach mikroskopowych gdyż powoduje odbijanie światła od preparatu.
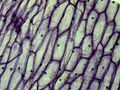
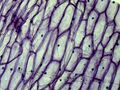
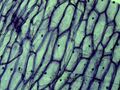
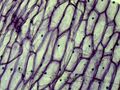
Jeżeli przełącznik trybu oświetlenia ustawimy w położeniu "I", zapewni to podświetlenie preparatu od dołu (światło przechodzące), w położeniu "II" — zapewni oświetlenie górne. położenie "III" przełącznika zapewnia oba rodzaje oświetlenia jednocześnie. Różne tryby oświetlenia z regulacją natężenia oświetlenia umożliwiają dobór odpowiednich dla danego preparatu warunków oświetlenia. Obrotowy zestaw kolorowych filtrów poniżej stolika mikroskopu jest użyteczny podczas oglądania jasnych, barwionych preparatów. W osi optycznej należy ustawić odpowiedni rodzaj filtra uzależniony od obserwowanego obiektu. Kolorowe części obiektu (np. cząsteczki skrobi, pojedyncze komórki) będą lepiej widoczne (poniższa galeria zdjęć przedstawia komórki cebuli przy zastosowaniu różnych filtrów).
Aby umożliwić działanie oświetlenia elektrycznego, należy podłączyć kabel zasilający do gniazdka w mikroskopie oraz do gniazdka zasilającego. Mikroskop jest dostosowany do napięcia zasilającego 220-230V. Następnie należy włączyć przełącznik umieszczony z tyłu mikroskopu i ustawić wymagane natężenie oświetlenia za pomocą pokrętła regulacyjnego.