Chemia/Pierwiastki grupy 13 - borowce
Z Brain-wiki
Wersja z dnia 18:29, 3 cze 2015 autorstwa Magdaz (dyskusja | edycje) (Utworzono nową stronę "thumb|Borowce {|class="wikitable" !Pierwiastek !Konfiguracja elektronowa !Energia jonizacji (eV) !Promień jonowy (nm) !Elektroujemność !Potenc...")
| Pierwiastek | Konfiguracja elektronowa | Energia jonizacji (eV) | Promień jonowy (nm) | Elektroujemność | Potencjał [math]E_0[/math] (V) |
|---|---|---|---|---|---|
| Bor (B) | (He)2s22p1 | 8,30 | 0,020 | 2 | -0,87 |
| Glin (Al) | (Ne)2s22 p1 | 5,98 | 0,052 | 1,5 | -1,66 |
| Gal (Ga) | (Ar)2s22p1 | 6,00 | 0,060 | 1,6 | -0,53 |
| Ind (In) | (Kr)5s25p1 | 5,79 | 0,081 | 1,7 | -0,34 |
| Tal (Tl) | (Xe)6s26p1 | 6,11 | 0,095 | 1,8 | -0,34 |
Spis treści
- 1 Charakterystyka grupy 13
- 2 Jony borowców
- 3 Właściwości fizykochemiczne
- 4 Podstawowe reakcje borowców
- 5 Właściwości tlenków
- 6 Wodorki
- 7 Związki borowców z halogenami
- 8 Rozpuszczalność związków borowców w wodzie
- 9 Właściwości boru
- 10 Związki boru z deficytem elektronów
- 11 Właściwości glinu
- 12 Związki borowców na +1 stopniu utlenienia
Charakterystyka grupy 13
- Bor jest jedynym niemetalem w grupie, pozostałe są metalami o właściwościach amfoterycznych. Cechy amfoteryczne maleją od glinu do talu.
- Podstawowym stopniem utlenienia dla borowców jest +3. Stopień utlenienia +1 występuje tylko w związkach metali. W przypadku związków talu jest to trwalszy stopień utlenienia.
- Małe rozmiary i duży ładunek jonów oraz wysokie energie jonizacji powodują, że borowce tworzą głównie związki o wiązaniach kowalencyjnych. Bor tworzy tylko związki kowalencyjne. Związki pozostałych borowców (AlCl2, GaCl2) są kowalencyjne w stanie bezwodnym, ale w roztworach wodnych dysocjują na jony.
Jony borowców
- Bor bardzo silnie wiąże swoje elektrony walencyjne i nie tworzy kationów.
- Glin, gal, ind tworzą tylko jony M3+, natomiast tal tworzy jony M3+ i M+.
- Tendencja do tworzenia jonów rośnie w miarę przechodzenia w dół grupy.
- Wszystkie jony metali III grupy są hydratowane w środowisku wodnym. Podatność jonów na hydratacje maleje w szeregu Al3+ > Ga3+ > In3+ > Tl3+.
Właściwości fizykochemiczne
- Bor jest półprzewodnikiem, pozostałe pierwiastki są metalami.
- Bor w temperaturze pokojowej jest chemicznie bierny, bezpośrednio reaguje jedynie z fluorem i kwasem azotowym. W podwyższonej temperaturze łączy się z metalami tworząc borki o różnorodnych strukturach Mn4B, FeB, Cr2B, ZrB, CaB6.
- Glin metaliczny pokrywa się warstwą tlenku Al2O2, która nadaje mu odporność chemiczną (wysoka energia wiązania Al-O). Ze względu na mały promień jonowy i duży ładunek Al3+ tworzy wiele trwałych jonów kompleksowych: AlF2+, AlF2+, AlF4¯, AlF52-, AlF63-.
Podstawowe reakcje borowców
- Z tlenem
- 4 M (s) + 3 O2(g) → 2 M2O2 (s) (M = B, Al, Ga, In, Tl).
- Tlenki powstają też w wyniku termicznego rozkładu nietrwałych związków berylowców (węglanów, azotanów, siarczanów, wodorotlenków). W odróżnieniu od litowców i berylowców, borowce nie tworzą nadtlenków ani ponadtlenków.
- Z azotem
- 2 M(s) + N2(g) → 2 MN(s) (M = B, Al).
- Z fluorowcami 2B(s) + 3X2(g,c,s) → 2 BX2(g)
- 2 M(s) + 3X2(g,c,s) → M2X6(g) (M = Al, Ga, In),
- 2 Tl(s) + X2(g,c,s) → 2 TlX(s).
- Z wodą
- 2 Tl(s) + 2 H2O (c) → 2 TlOH(aq) + H2(g).
- Z kwasami
- 2 M(s) + 6 H2O+(aq) → 2 M3+(aq) + 6 H2O(c) + 3 H2(g) (Al, Ga, Tl).
- Z zasadami
- 2 M(s) + 2 OH¯(aq) + 6 H2O(c) → 2 M(OH)4¯ (aq) + H2(g) (Al, Ga).
Właściwości tlenków
- Powstają w reakcji z tlenem przebiegającej w podwyższonej temperaturze
- 2 M + 3/2 O2 → M2O2.
- B2O2 — tlenek kwasowy
- B2O2 (s)+ 6 NaOH(aq) → 2 Na2BO2(aq) + 3 H2O.
- Tl2O2 — tlenek zasadowy
- Tl2O2 (s) + 6 HCl (aq) → 2 TlCl2(aq) + 3 H2O.
- Al2O2, Ga2O2, In2O2 — tlenki amfoteryczne
- Al2O2(s) + 6 NaOH(aq) + 3H2O → 2 Na2 [Al(OH6)](aq) + H2O,
- Al2O2(s) + 6 HCl (aq) → 2 AlCl2(aq) + 3 H2O.
Wodorki
- Borowce nie reagują z wodorem bezpośrednio (można je otrzymać w reakcjach pośrednich).
- Bor tworzy różnorodne połączenia z wodorem (B2H6, B4H10, B10H16), a pozostałe pierwiastki tylko wodorki typu MH2.
- Wodorki wszystkich borowców są silnymi reduktorami — reagują z wodą wydzielając wodór:
- B2H6 + 6H2O → 2H2BO2 + 6H2
- MH2 + 3H2O → M(OH)3 + 3H2
Związki borowców z halogenami
- Wszystkie borowce tworzą monohalogenki MX w fazie gazowej, w wysokiej temperaturze. Z wyjątkiem TlF, wszystkie są związkami kowalencyjnymi. Halogenki talu TlX są trwalsze niż halogenki TlX2.
- Bor tworzy dihalogenki o wzorze M2X4, w których występuje wiązanie B-B. Gal oraz ind tworzą dihalogenki MX2, które są związkami kompleksowymi (metale przyjmują stopnie utlenienia +1 i +3).
- Wszystkie borowce tworzą trihalogenki MX3 (M oznacza atom borowca). Fluorki mają budowę jonową, wysokie temperatury topnienia i są słabo rozpuszczalne w wodzie. Pozostałe halogenki są w znacznym stopniu kowalencyjne, w fazie gazowej oraz w środowiskach niepolarnych występują w postaci dimerów (MX2)2.
- W roztworach wodnych trihalogenki ulegają hydrolizie. Halogenki boru hydrolizują z utworzeniem kwasu borowego
- 4 BF3 + 3 H2O → H3BO3 + 3H[BF4],
- BX3 + 3 H2O → H3BO3 + 3HX (X = Cl, Br, I).
- Halogenki pozostałych borowców hydrolizują z utworzeniem wodorotlenków
- MX3 + 3H2O → M(OH)3 + 3H+ + 3X¯ (M = Al, Ga, In, Tl; X = F, Cl, Br, I).
- Z nadmiarem jonów halogenkowych niektóre borowce tworzą jony kompleksowe — [AlF6]3-, [GaF6]3-, [InCl6]3-, [TlCl4]3-.
Rozpuszczalność związków borowców w wodzie
- Związki borowców, dla których energia hydratacji jest większa od energii sieciowej, są dobrze rozpuszczalne w wodzie (azotany, halogenki z wyjątkiem niektórych fluorków, siarczany, niektóre siarczki).
- Kwas ortoborowy H2BO2 i tlenek boru B2 O2 są dobrze rozpuszczalne w wodzie.
- Al2O2 wykazuje minimalną rozpuszczalność w wodzie, pozostałe tlenki borowców są nierozpuszczalne.
- Wodorotlenki borowców M(OH)3 (M = Al, Ga, In, Tl) są trudno rozpuszczalne, a ich iloczyny rozpuszczalności maleją ze wzrostem liczby atomowej borowca.
- Siarczki B2S2, Al2S2, Ga2 S2 są dobrze rozpuszczalne w wodzie, odpowiednie siarczki indu i talu są nierozpuszczalne.
- Wszystkie ortofosforany MPO4 i ortoarseniany MAsO4 borowców (M = Al, Ga, In, Tl) są najtrudniej rozpuszczalnymi w wodzie związkami tych metali.
Właściwości boru
- Borki metali II grupy MB2 reagują z kwasami z wytworzeniem związków borowodorowych, o zróżnicowanym składzie (od gazowego B2H6 do stałego B18H22), które podczas ogrzewania bez dostępu powietrza ulegają rozkładowi na bor i wodór.
- Jedynym ważnym tlenkiem boru jest B2O2, który po rozpuszczeniu w wodzie tworzy słaby kwas borowy H2BO2 (o właściwościach antyseptycznych):
- B2O2 + 3H2O → 2H2BO2
- Borany powstają przez zobojętnianie kwasu borowego lub w reakcjach B2O2 z tlenkami zasadowymi.
- Halogenki boru (BF2, BCl2, BBr2, BJ2), ze względu na niedobór dwóch elektronów chętnie przyłącza parę elektronową, tworząc związki addycyjne np. F2B:NH2 (w którym wolna para elektronowa pochodzi od atomu azotu).
Związki boru z deficytem elektronów
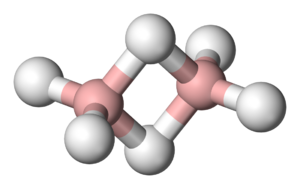
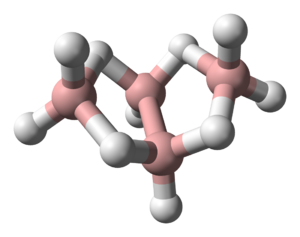
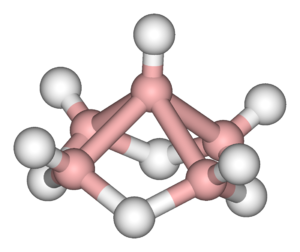
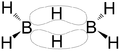
Borowodory stanowią 2 typy połączeń boru z wodorem określone wzorami: [math]\mathrm B_n\mathrm H_{n+4}[/math] oraz [math]\mathrm B_n\mathrm H_{n+6}[/math] [math](n\gt 2)[/math]
| diboran B2H6 | tetraboran B4H10 | pentaboran B5H9 |
Są to związki elektronodeficytowe, w których występuje struktura mostkowa (wiązanie trójcentrowe B-H-B), którą stanowi orbital molekularny złożony z orbitalu sp3 jednego atomu boru (B), orbitalu 1s atomu wodoru (H) i sp3 drugiego atomu boru (B). Na każdym orbitalu znajduje się para elektronów.
Właściwości glinu
- Glin jest odporny na działanie kwasów organicznych, ale w obecności niektórych mocnych kwasów nieorganicznych (HCl, H2SO4) ochronna warstwa tlenku ulega rozpuszczeniu i metal reaguje z jonami H+:
- 2Al + 6H+ → 2Al3+ + 3H2.
- W stężonych roztworach mocnych zasad glin rozpuszcza się tworząc gliniany:
- 2Al + 2NaOH + H2O → 2NaAlO2.
- W roztworach wodnych zawierających siarczany jony Al3+ tworzą sole podwójne (tzw. ałuny) o wzorze MAl(SO4)∙12H2O.
- Podczas dodawania mocnej zasady do wodnych roztworów Al3+ wytrąca się biały, galaretowaty osad wodorotlenku Al(OH)3 , który zaraz po utworzeniu łatwo rozpuszcza się w kwasie lub nadmiarze zasady. W miarę upływu czasu rozpuszczalność osadu maleje, na skutek tworzenia mostków tlenkowych między sąsiednimi jonami glinu.
Związki borowców na +1 stopniu utlenienia
- W miarę wzrostu liczby atomowej borowce wykazują coraz silniejszą tendencję do przyjmowania stopnia utlenienia +1. W przypadku talu jest to trwalszy stopień utlenienia (wzrasta trwałość konfiguracji ns2).
- Znane są nieliczne związki jednowartościowego glinu: Al2O, Al2S, Al2Se, AlH, AlCl.
- Chlorki galu i indu o strukturach Ga(GaCl4) i In(InCl4) zawierają jeden atom metalu na stopniu utlenienia +1, a drugi na stopniu utlenienia +3.
- Jon Tl+1 wykazuje w związkach właściwości zbliżone do właściwości jonów litowców, pod pewnymi względami przypomina też jon Ag+.
- TlOH jest dobrze rozpuszczalną, silną zasadą. W czasie ogrzewania w temp. 100°C ulega rozkładowi z utworzeniem Tl2O w postaci czarnego higroskopijnego proszku. Halogenki i siarczki talu są trudno rozpuszczalne w wodzie, podobnie jak związki srebra. Wszystkie rozpuszczalne związku talu są trujące.