Metody Biofizyki Molekularnej/Chromatografia
Spis treści
- 1 Definicja
- 2 Pojęcia podstawowe
- 2.1 Faza stacjonarna i ruchoma (mobilna)
- 2.2 Współczynnik podziału (partition coefficient)
- 2.3 Czas i objętość retencji (retention time [math](t_R)[/math], volume [math](V_R)[/math])
- 2.4 Współczynnik migracji
- 2.5 Rozdzielczość
- 2.6 Liczba półek teoretycznych (N)
- 2.7 Wysokość półki teoretycznej
- 2.8 Poszerzenie pików
- 2.29">2.9 Krzywa van Deemetera (Rys. Figure 2)
- 2.10 Współczynnik pojemności, [math]V_1[/math]
- 2.11 Współczynnik rozdziału
- 2.12 Uwagi
- 3 Elementy cieczowego systemu chromatograficznego
- 4 Typy chromatografii cieczowej
- 5 Rodzaje chromatografii cieczowej
- 6 Projektowanie procedury oczyszczania
- 7 Chromatografia gazowa (Gas chromatography, GC)
Definicja
Początkowo chromatografia dotyczyła separacji barwników na składowe obserwowalne w świetle widzialnym. Jednym z pionierów tej techniki rozdziału substancji był Michaił Cwiet, który na Politechnice Warszawskiej w 1905 roku dokonał separacji barwników w sproszkowanym węglanie wapna (w kredzie).
Obecnie chromatografia (gr. chromatos = barwa + grapho = pisze) to technika analityczna lub preparatywna służąca do badania (rozdzielania) składu mieszanin związków chemicznych. Wykorzystuje się w niej różnice w podziale składników mieszaniny między fazę stacjonarną i ruchomą.
Pojęcia podstawowe
Faza stacjonarna i ruchoma (mobilna)
W chromatografii podział składników próbki odbywa się pomiędzy dwiema fazami, stacjonarną (np. złoże kolumny), do którego przyczepia się część składników próbki oraz ruchomą (np. bufor), razem z którą przemieszczają się inne składniki próbki pomiędzy ziarnami fazy stacjonarnej.
Materiały tworzące fazę stacjonarną powinny być stabilne mechanicznie, niereaktywne chemicznie w warunkach ich zastosowań w chromatografii oraz powinny spełniać dodatkowe wymagania (hydrofobowość, powinowactwo do ligandu) związane ze konkretnym typem chromatografii. Typowe obojętne złoża to: celuloza, agaroza, sephadex, poliakrylamid, polistyren. Złoża te różnią się wielkością ziaren, porowatością itp. Do nich przyłącza się grupy aktywne związane ze stosowanym typem chromatografii.
Skład fazy ruchomej jest ściśle związany z materiałem próbki oraz z zastosowana metodą chromatograficzną, może być ustalony, zmieniać się skokowo lub w sposób ciągły.
Współczynnik podziału (partition coefficient)
- [math]K=\frac{C_s}{C_m}[/math]
gdzie: [math]C_s, C_m[/math] — stężenie molekuł danego rodzaju w fazie stacjonarnej i mobilnej. K' zależy od warunków eksperymentu (temperatura, polarność roztworu itp.).
Czas i objętość retencji (retention time [math](t_R)[/math], volume [math](V_R)[/math])
- [math]V_r=f\cdot t_R[/math]
gdzie: f – szybkość przepływu (ml/min).
Retencja zależy od powinowactwa cząsteczek do fazy ruchomej lub stacjonarnej i charakteryzuje czas przebywania substancji chromatografowanej w kolumnie chromatograficznej.
Współczynnik migracji
Określa jak szybko porusza się dany składnik próbki w stosunku do prędkości czoła fazy ruchomej.
- [math]R_F = \frac{V_S}{V_{MF}} = \frac{L_S}{L_{MF}}[/math]
gdzie: [math]V_S,\ L_S[/math] — prędkość ruchu i położenie składnika próbki, [math]V_{MF},\ L_{MF}[/math] 7mdash; prędkość ruchu i położenie czoła fazy ruchomej.
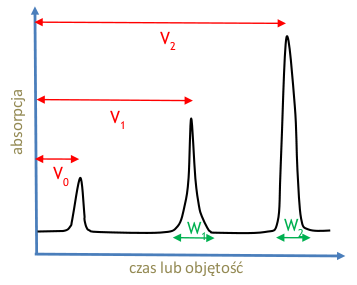
Rozdzielczość
Charakteryzuje zdolność do separacji cząsteczek. Pozwala ustalić jak efektywna jest dana kolumna w separacji składników próbki.
- [math]R=\frac{V_2-V_1}{\frac{W_1+W_2}2}[/math]
gdzie: W — szerokość piku u podstawy dla danego składnika próbki, V — objętość retencji.
Rozdzielczość jest tym lepsza im piki są węższe (mała wartość W) i im lepiej rozseparowane (duże [math]V_2-V_1[/math]).
[math]V_0[/math] — objętość po jakiej czoło fazy ruchomej dociera do końca kolumny. Jest równa objętości kolumny i doprowadzeń roztworu minus objętość substancji, którą kolumna jest upakowana (Rys. Figure 1)
Liczba półek teoretycznych (N)
Liczba równowag absorpcji i desorbcji wzdłuż kolumny. Jest to wielkość charakteryzująca kolumnę i bezpośrednio zależy od wielkość cząsteczek tworzących fazę stałą. Im wyższe N tym lepszy rozdział.
- [math]N = C \frac{t_R^2}W[/math]
gdzie [math]t_R[/math] — czas retencji, W — szerokość u podstawy dla danego piku.
Wysokość półki teoretycznej
Dwie kolumny o różnej długości mogą mieć tą sama ilość półek teoretycznych. Wtedy lepsza jest krótsza kolumna. Określamy wysokość półki teoretycznej jako
- [math]H\frac LN[/math]
gdzie L — długość kolumny. Im lepsza kolumna tym mniejsze H. Im więcej półek teoretycznych tym mniejsze poszerzenie piku.
Poszerzenie pików
Nawet jeśli na kolumnę nałożymy pojedynczą próbkę w małej objętości [math]V_a[/math] to schodzący pik będzie miał pewną szerokość i większą objętość [math]V_b[/math] od nałożonej [math]V_a[/math].
Poza niewielka ilością półek teoretycznych wyróżniamy następujące przyczyny poszerzenia pików:
- Dyfuzja wirowa.
- [math]H_1=c_ed_p[/math]
- Rozdział masy fazy ruchomej.
- [math]H_2=\frac{C_m d_p 2v}{D_m}[/math]
- Zatrzymanie przepływu fazy ruchomej.
- [math]H_3= \frac{C_{sm}d^2_pv}{D_m}[/math]
- Oddziaływanie próbki z fazą stacjonarną .
- [math]H_4=\frac{C_sd^2_f v}{D_s}[/math]
gdzie : [math]C_i[/math] — współczynniki dla cząsteczek tworzących fazę stacjonarną, [math]d_p[/math] — średnica cząsteczek fazy stacjonarnej, [math]d_f[/math] — grubość fazy stacjonarnej, [math]v\;[/math] —szybkość przepływu fazy mobilnej, [math]D_m[/math] i [math]D_s[/math] — współczynniki dyfuzji próbki w fazie ruchomej i stacjonarnej.
- [math]H=H_1+H_2+H_3+H_4[/math]
[math]H_4[/math] małe, możemy pominąć oraz zapisać równanie w postaci:
- [math]H = d_p\left(C_e+\frac{C_md_pv}{D_m}+\frac{C_{sm}d_pv}{D_m}\right)[/math]
Obniżenie H może nastąpić poprzez zmniejszenie: średnicy cząstek fazy stacjonarnej [math]d_p[/math], przepływu [math]v[/math], rozmiaru cząsteczek próbki [math]D_m[/math].
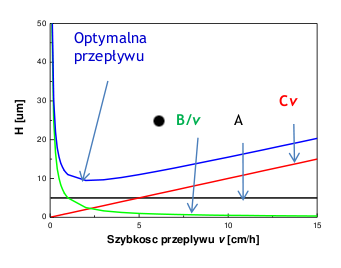
2)">2.29">Krzywa van Deemetera (Rys. Figure 2)
Zależność H od szybkości przepływu fazy mobilnej, może być wykorzystywana do wyznaczenia optymalnej szybkości przepływu fazy mobilnej. Korzysta się z empirycznego równania:
- [math]H=A+\frac Bv +Cv[/math]
A — dyfuzja wirowa, B — dyfuzja wzdłuż kierunku ruchu fazy mobilnej, C' — przeniesienie masy.
Współczynnik pojemności, [math]V_1[/math]
Możemy go zapisać jako:
- [math]V_1=V_0(1+k_2)[/math]
[math]V_0[/math] — objętość po jakiej czoło fazy ruchomej dociera do końca kolumny,[math]k_1[/math] — współczynnik pojemności dla składnika 1.
Współczynnik rozdziału
Definiujemy współczynnik rozdziału jako:
- [math]\alpha = \frac{k_1}{k_2}[/math]
Im jest on wyższy, tym lepszy jest rozdział chromatograficzny.
Uwagi
Kształt pików zwykle odbiega od krzywej Gaussa.
Możliwe przyczyny: nieliniowa szybkość przepływu, niecałkowite rozdzielenie pików, stosowanie gradientu przy wymywaniu substancji
Wprowadzone pojęcia są niezależne od rodzaju rozdziału chromatograficznego i typu próbki, mogą być stosowane do porównania różnych typów chromatografii.
Dla dobrego rozdziału chromatograficznego wymagamy:
- wysokiej rozdzielczości (R),
- dużej liczby półek teoretycznych (N),
- niskiej wysokości półki teoretycznej (H)
- wysokiej wartości współczynnika rozdziału ([math]\alpha[/math]).
Elementy cieczowego systemu chromatograficznego
- Bufory w rezerwuarach stanowiące fazę mobilną
- Mikser
- Pompy
- Iniektor
- Kolumna zawierająca materiał fazy stacjonarnej
- Detektor
- Rejestrator
- Kolektor frakcji
Materiał fazy stacjonarnej i mobilnej zależy od właściwości separowanego układu.
Typy chromatografii cieczowej
Filtracja żelowa (inaczej: sita molekularne, size exclusion chromatography, SEC)
Białka są rozdzielane ze względu na ich wielkość, masę i kształt. Cząsteczki za duże dla danego złoża nie wnikają w jego pory i przechodzą przez kolumnę razem z czołem fazy ruchomej Natomiast małe cząsteczki błądzą w żelu, im mniejsze tym dłużej przebywają w złożu. Zakres rozdziału molekuł metodą filtracji żelowej jest ściśle związany z zastosowanym złożem (typowe złoża to: sephadex, sepharose, saphacryl, biogel, fractogel).
Zastosowanie filtracji żelowej:
- Usuwanie składników o małej masie z próbki (odsalanie). Zastosowanie w przypadku wymiany buforów bez znacznego rozcieńczania próbki.
- Wyznaczanie masy próbki (np. natywnego białka) przy znanych masach markerów nakładanych na kolumnę razem z próbka lub osobno.
- Rozdział peptydów, białek, kwasów nukleinowych, kompleksów białkowych i wirusów ze względu na różnicę mas.
Chromatografia jonowymienna
W chromatografii jonowymiennej wykorzystuje się zależność wielkości ładunku białka w roztworze od jego składu aminokwasowego i struktury, a tym samym od punktu izoelektrycznego (pI) oraz od pH roztworu.
Pierwszym etapem separacji jest odwracalne wiązanie biomolekuł ze złożem. Białka w buforach o pH < pI będą się wiązać z wymieniaczem jonowym poprzez jego grupy karboksylowe (z kationitem), białka w buforach o pH >pI będą wiązane przez anionity, natomiast nie związane z kolumną związki zostaną wypłukane.
Do rozdziału tego samego białka można używać zarówno anionitów i kationitów. Związane białka o ładunku ujemnym wymywa się z kolumny buforem o zwiększającym się stężeniu chlorku sodu. Jony chloru współzawodniczą z ujemnymi grupami białka o miejsca wiązania na złożu wypełniającym kolumnę. Pierwsze uwalniają się białka słabo związane.
Złoże w chromatografii jonowymiennej tworzy baza powiązana z związkami chemicznymi, t.zw. wymieniaczami jonowymi. Mogą to być wymieniacze anionowe lub kationowe, słabe (wąski zakres pH) i silne (pracujące w szerokim zakresie pH).
Związki chemiczne związane ze złożem to naładowane dodatnio (anionity) lub ujemnie (kationity) zawierające grupy polarne takie jak:
- dwuetyloaminoetylowa (DEAE) –OCH2CH2NH+(CH2CH3)2 (słaby anionit, zakres pH 2 - 9),
- czwartorzędowa zasada aminowa (QAE) – OCH2CH2N+(C2H5)CH2-CH(OH)-CH3 (silny anionit, zakres pH 2 - 12),
- reszta kwasu fosforowego –PO4H2- (silny kationit, zakres pH 2 - 12),
- karboksymetylowa (CM) –OCH2COO- (słaby kationit, zakres pH 6 - 11).
Chromatografia powinowactwa
Chromatografia powinowactwa stosowana jest do rozdziału białek ze względu na ich duże powinowactwo do specyficznych ligandów, które związane są ze złożem. Procedura obejmuje następujące etapy:
- kowalencyjne przyłączenie liganda do złoża ,
- nałożenie mieszany białek i przemycie kolumny w celu usunięcia niezwiązanych cząsteczek,
- elucja związanych z kolumną białek.
Ligandy stosowane w chromatografii powinowactwa musza spełniać następujące warunki:
- posiadanie co najmniej jednej grupy aktywnej, która umożliwia związanie do złoża np. aminowej, amidowej, karboksylowej, hydroksylowej, tiolowej,
- powinowactwo do związku oczyszczanego,
- stabilność w warunkach reakcji wiązania do złoża .
Wiązanie ligandów
Ligandy mogą być połączone bezpośrednio ze złożem lub poprzez „ruchome ramię”. Poprzez ramię łączy się ligandy o niskiej masie cząsteczkowej oraz takie, do których przy bezpośrednim połączeniu dostępność będzie ograniczona. Zwykle jako ramię stosuje się nierozgałęziony łańcuch węglowodorowy, na którego końcu znajduje się grupa aktywna za pomocą której łączy się ligand.
Aktywacja złoża
Złoże (celuloza, agaroza, sephadex, poliakrylamid i inne) aktywuje się z użyciem odczynników jak aldehyd glutarowy (białka, kwasy nukleinowe, aminy), siarczan dwuwinylu (wielocukry, aminy, grupy tiolowe i fenolowe), benzochinon (białka, wielocukry, aminy), epichlorohydryna (wielocukry, kwasy nukleinowe, aminy, grupy tiolowe i fenolowe).
Do zaktywowanego złoża przyłącza się ligand metodą inkubacji złoża z rozpuszczonym ligandem, a następnie wysyca pozostałe miejsca aktywne na złożu inkubując kolumnę z etanoloaminą lub innymi aminami takimi jak: lizyna, glukozamina. Zaktywowane złoże przechowuje się w obecności 0,02% azydku sodu lub mertiolatu w temperaturze 4°C.
Elucja białek z kolumny
Białka związane z kolumną wymywa się odpowiednim buforem. Jako bufor elucyjny najczęściej stosuje się:
- roztwór liganda ,
- roztwory zawierające jony chaotropowe najczęściej 3M roztwór rodanku potasu,
- roztwory o niskim pH np. bufor octanowy o pH 3.0, bufor glicynowy o pH 2.5-3,
- roztwory mocznika lub siarczanu dodecylu.
W przypadku denaturacji białka podczas elucji należy pamiętać, aby ten proces przeprowadzić możliwie jak najszybciej oraz szybko usunąć czynnik denaturujący z wyeluowanego białka. C zasem można stosować gradient powinowactwa, polegający na stopniowym zwiększaniu w fazie ruchomej zawartości konkurującego ligandu. Jest to sposób separacji izoenzymów różniących się powinowactwem do ligandu.
Popularne zastosowanie chromatografii powinowactwa:
- białka eksprymowane w E. coli z glutatione-S-transferazą (GST),
- GST wiąże się z glutationowo-agarozową kolumną,
- białka mogą być wymywane za pomocą glutationu,
- białko właściwe jest odłączane dzięki trawieniu trombiną miejsca połączenia z GST.
Chromatografia powinowactwa do unieruchomionych jonów metali (IMAC, Immobilised Metal Affinity Chromatography)
Odmianą chromatografii powinowactwa jest chromatografia powinowactwa do unieruchomionych jonów metali (IMAC, Immobilised Metal Affinity Chromatography).
W tym przypadku faza stacjonarna jest powiązana z metalem, np.:Cu,Zn, Ca, Ni, Fe, z którym łączą się odpowiednie obszary białka.
Przykład: system z His-tagiem — białko jest eksprymowane z ogonem histagowym, który łączy się z niklem. Histag może być usuwany z pomocą enterokinazy.
Chromatografia odwróconej i normalnej fazy
W chromatografii odwróconej fazy faza stacjonarna jest niepolarna (np. polimery), a faza ruchoma jest fazą polarną (np. woda, metanol).
Cząsteczki biologiczne i ich fragmenty różnią się hydrofobowością. Fragmenty hydrofobowe wiążą się z hydrofobowym złożem (węglowodorowym). Krótsze łańcuchy węglowodorów wiążą białka, dłuższe — peptydy. W metodzie chromatografii odwróconej fazy białka są często zdenaturowane — jest to dobra metoda do analizy białek, ma mniejsze zastosowanie w oczyszczaniu aktywnych biologicznie cząsteczek.
W procesie separacji próbkę nakłada się w polarnym rozpuszczalniku (woda, metanol), a następnie wymywa się poprzez zwiększający gradient roztworów organicznych (acetonitryl). Polarne próbki wymywane są w pierwszej kolejności ze względu na słabe oddziaływania z hydrofobowa powierzchnią.
W porównaniu z innymi typami chromatografii niewielka zmiana polarności, temperatury i pH powoduje bardzo szybka reakcję składników próbki — bardzo duża rozdzielczość metody.
Chromatografia normalnej fazy jest rzadziej stosowana. W tym przypadku faza stacjonarna jest polarna, a faza ruchoma niepolarna. Technika jest użyteczna dla białek słabo rozpuszczalnych, a ponieważ wprowadzono ją jako pierwszą stąd nazwa chromatografia fazy normalnej.
Chromatografia oddziaływań hydrofobowych
Rozpuszczalne białka posiadają wodną otoczkę solwatacyjną, zasłaniającą grupy hydrofobowe. W obecności reagentów wiążących wodę z otoczki, np. (NH4)2SO4, otoczkę można przerwać i wyeksponować grupy hydrofobowe. W tym przypadku fazę stacjonarną stanowią związki hydrofobowe, np. oktyl lub fenyl, a wymywanie odbywa się poprzez wzrost polarności roztworu (np. zmniejszanie stężenia (NH4)2SO4).
Porównanie chromatografii oddziaływań hydrofobowych z chromatografią odwróconej fazy
Hydrofobowa faza mobilna w chromatografii odwróconej fazy często denaturuje białko. Chromatografia odwróconej fazy zależy od całkowitej hydrofobowości białka.
W chromatografii oddziaływań hydrofobowych oddziaływania są związane z delikatnym uszkodzeniem otoczki solwatacyjnej — oddziaływania hydrofobowe występują pomiędzy powierzchnią białka i fazą stacjonarną — białka oczyszczane są w stanie aktywnym biologicznie.
Zastosowanie kolumn w zależności od typu chromatografii:
- Filtracja żelowa — długie i wąskie kulumny.
- Chromatografie związane z absorpcją cząstek przez złoże — krótkie i szerokie kolumny.
Rodzaje chromatografii cieczowej
Chromatografia otwartokolumnowa
- Czasochłonna (godzinę lub dni, konieczność utrzymania niskiej temperatury),
- niska rozdzielczość,
- tania — wygodna do oczyszczań preparatywnych, kolumny o dużej pojemności,
- faza stała złożona z żeli policukrowych jest miękka, stosuje się ciśnienie atmosferyczne,
- zastosowanie w przemyśle np. produkcja białek o znaczeniu farmaceutycznym, diagnostycznym (reagenty, dodatki do żywności).
HPLC (High Performance Liquid Chromatography – wysokosprawna chromatografia cieczowa)
- Najczęściej opiera się na chromatografii odwróconej fazy (RP).
- Wysokie ciśnienie, przekraczające 100 atm w układzie HPLC wynika z:
- budowy pomp HPLC (wąskie przekroje kapilar),
- typu wypełnienia kolumn,
- stosowanego przepływu fazy ruchomej (od ułamków ml/min do kilkudziesięciu ml/min).
- Wysoka sprawność i rozdzielczość układu HPLC umożliwia rozdział analizowanych mieszanin na poszczególne związki chemiczne w krótkim czasie, przy niewielkim zużyciu eluenta i małej ilości analizowanej próbki.
- Analiza próbki o objętości od 1 do 200 µl w analitycznej HPLC(w preparatywnej do kilkudziesięciu mililitrów) trwa od kilku do kilkudziesięciu minut.
- Kolumny HPLC mają przeciętnie długość od 3 do 25 cm, przekrój wewnętrzny rzędu kilku milimetrów i mogą być zestawiane w układy.
- Zużycie eluenta to kilkudziesiąt mililitrów (głównie są to rozpuszczalniki organiczne: metanol, chlorek metylenu, THF, toluen, etanol, acetonitryl i inne.)
Budowa aparatu HPLC
- Zbiornik na bufory,
- automatyczny odgazowywacz,
- zawory proporcjonujące, w których faza ruchoma osiąga zadany skład,
- pompy,
- nastrzykiwacz (iniektor) umożliwiający wprowadzanie analizowanych próbek bez rozszczelnienia układu,
- odpowiednie filtry,
- prekolumna, która usuwa z eluenta zanieczyszczenia, mogące zniszczyć wypełnienie kolumn,
- kolumna (kolumny) z odpowiednim wypełnieniem,
- termostat,
- detektor przepływowy: spektrofotometr UV-VIS absorpcyjny lub fluorescencyjny, spektrometr mas, laserowy spektrometr rozproszeniowy, amperometr,
- kolektor frakcji,
- zbiornik na zużyty eluent.
Chromatografia FPLC (Fast Protein Liquid Chromatography)
Nie zawsze HPLC jest idealnym rozwiązaniem:
- wymaga organicznych rozpuszczalników, które denaturują białka,
- kolumny dedykowane HPLC o dużej pojemności są drogie, a małe mają mniejszą pojemność,
- FPLC lepsze do rozdziału pochodnych DNA, nukleotydów, peptydów, białek, biopolimerów,
- niższe ciśnienia, mniej przecieków,
- różne kolumny, różne fazy stacjonarne i ruchome,
- ciśnienia stosowane w FPLC są znacznie niższe niż w HPLC, max. 3-4 Mpa, co skutkuje dłuższym czasem separacji cząstek.
Chromatografia perfuzyjna
- Chromatografia perfuzyjna umożliwia duże szybkości przepływu ze względu na nowy typ cząsteczek fazy stacjonarnej, a w związku z tym bardzo szybka separację cząsteczek.
- W chromatografii perfuzyjnej cząsteczki fazy stacjonarnej posiadają duże prawie 1 μm kanały, prze które ułatwiony jest szybki przepływ fazy mobilnej.
- Cząsteczki wykorzystywane w chromatografii perfuzyjnej nazywane są POROS.
Chromatografia membranowa
- warstwy membran zamiast kolumny.
Projektowanie procedury oczyszczania
- Zdefiniować cel pracy (jakie białko, ilość, aktywność i czystość).
- Określić właściwości białka i krytycznych zanieczyszczeń.
- Określić metodę rozróżnienia białka i zanieczyszczeń.
- Wybrać procedurę oczyszczania.
- Zminimalizować czas kolejnych etapów oczyszczania.
- Zminimalizować ilość dodawanych odczynników.
- Jak najwcześniej zneutralizować/usunąć zanieczyszczania szkodzące białku (np. proteazy).
- Używać różnych technik na każdym etapie oczyszczania (wykorzystać różne właściwości białka: hydrofobowość, powinowactwo, rozmiar, ładunek).
- Zminimalizować liczbę etapów oczyszczania.
Chromatografia gazowa (Gas chromatography, GC)
- Fazę mobilną stanowi niereaktywny chemicznie gaz (najczęściej hel, argon, azot, dwutlenek węgla).
- Umożliwia ustalenie procentowego składu mieszanin związków chemicznych, nawet dla kilkuset związków.
- Detekcja klasyczna umożliwia przybliżoną identyfikację składników mieszaniny na podstawie czasu retencji.
- Pełna identyfikacja – gdy detektorem jest spektrometr masowy.
Zastosowanie: szybka analiza mieszanin związków chemicznych oraz ocena czystości tych związków w: przemyśle petrochemicznym, ochronie środowiska, kryminalistyce, kontroli antydopingowej, w przemyśle spożywczym.
Zaleta chromatografii gazowej — możliwość użycia niewielkiej próbki analizowanej substancji - od 0,01 μl.
Chromatografia gazowa opiera się na zjawisku występowania oddziaływań międzycząsteczkowych między składnikami analizowanej mieszaniny i wypełnieniem kolumn.
Analizowana mieszanina jest przeprowadzana w fazę gazową w odparowywaczu. Następnie próbka jest porywana przez gaz nośny i przechodzi przez długą kolumnę chromatograficzną, umieszczoną w termostatowanym piecu, gdzie następuje rozdział mieszaniny na poszczególne związki chemiczne. Na wyjściu znajduje się detektor, za pomocą którego wykrywa się i mierzy stężenie składników mieszaniny w gazie nośnym oraz rejestrator.
Na czas retencji wpływ mają warunki analizy: temperatura, szybkość przepływu gazu nośnego, wymuszanego przez ciśnienie podawane na szczyt kolumny.
Czas retencji w danych warunkach jest wartością specyficzną dla każdego składnika analizowanej mieszaniny.
Składniki próbki analizowane metodą chromatografii gazowej muszą być lotne i trwałe w temperaturze analizy. Najczęściej są to rozmaite mieszaniny gazów i roztwory zawierające lotne związki chemiczne.
Układ wprowadzania próbki
Układ nastrzykowy składa się z membrany, którą nakłuwa się igłą strzykawki chromatograficznej oraz odparowywacza, w którym następuje odparowanie składników próbki. Odparowywacz to rurka metalowa lub szklana otoczona spiralą grzejną, która rozgrzewa rurkę do ponad 200 °C.
Nastrzyki wykonuje się ręcznie (za pomocą strzykawki) lub automatycznie (z użyciem autodozownika).
Autodozownik to urządzenie, w którym wstawia się fiolki z analizowanymi mieszaninami w odpowiednich miejscach a specjalny manipulator pobiera do strzykawki odpowiednią objętość analizowanej próbki i nastrzykuje ją do aparatu.
Najważniejszą częścią układu nastrzykowego jest miejsce, do którego trafia próbka po pobraniu jej przez autodozownik lub strzykawkę.
- dozownik typu split — nastrzyknięta próba trafia do rozdzielacza, w którym ściśle ustalona część nastrzyku jest kierowana do odparowywacza, reszta trafia do tzw. martwej pętli.
- dozownik on-column — cała próbka trafia od razu na kolumnę.
Podstawowe rodzaje kolumn
- Kolumny z wypełnieniem stałym.
- Kolumny z wypełnieniem stało-ciekłym.
- Kolumny kapilarne.
Piec — odizolowany od otoczenia i wysokowydajny grzejnik z dokładną kontrolą temperatury. Wewnątrz pieca umieszczona jest zwinięta w pętlę kolumna.
Detektor w chromatografie gazowym mierzy stężenie wypływających związków w gazie nośnym.
Przykłady detektorów:
- Detektor płomieniowo-jonizacyjny (FID).
- Detektor foto-jonizacyjny [PID].
- Detektor masowy.
Rejestrator — zwykle komputery wraz z oprogramowaniem umożliwiającym sterowanie parametrami pracy całego aparatu i gromadzenie oraz analizowanie chromatogramów.