Pracownia Podstaw Biofizyki/PPB10
Czytnik mikropłytek — pomiary absorpcji i fluorescencji tryptofanu dr Anna Modrak-Wójcik
Spis treści
Wstęp
Celem ćwiczenia jest zapoznanie się z zasadą działania i obsługi wielofunkcyjnego czytnika mikropłytek oraz przeprowadzenie pomiarów absorpcji i fluorescencji tryptofanu.
Zjawisko absorpcji i emisji promieniowania elektromagnetycznego w zakresie UV/Vis
Długości fali wywołujące zmiany stanów elektronowych cząsteczki mieszczą się w zakresie 100-800 nm. Rozkład poziomów elektronowych oraz intensywność absorbowanego lub emitowanego promieniowania zależą od struktury i mikrootoczenia cząsteczek.
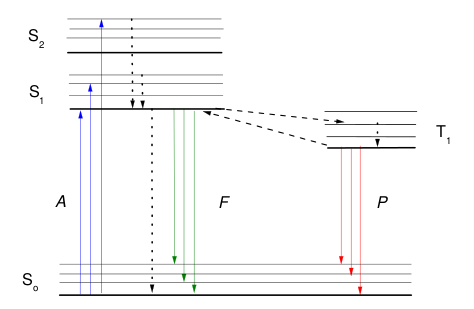
Podstawowe procesy zachodzące w cząsteczce wzbudzonej do wyższego stanu elektronowego w wyniku absorpcji promieniowania elektromagnetycznego przedstawia schematycznie diagram Jabłońskiego (Rys. Figure 1). Po zaabsorbowaniu energii cząsteczka dąży do powrotu do stanu równowagi termodynamicznej określonego przez boltzmanowski rozkład energii, czyli w warunkach temperatury pokojowej do najniższego poziomu oscylacyjnego podstawowego stanu elektronowego [math]S_0\;[/math]. Może to osiągnąć w wyniku procesów bezpromienistych, w których część energii jest przekształcana na energię ruchów oscylacyjnych, rotacyjnych lub translacyjnych cząsteczki lub na drodze procesów promienistych związanych z emisją pochłoniętego fotonu czyli w wyniku fotoluminescencji. Z wyższych stanów wzbudzonych cząsteczka bardzo szybko przechodzi w wyniku dezaktywacji bezpromienistej do najniższego poziomu oscylacyjnego pierwszego singletowego stanu wzbudzonego [math]S_1\;[/math] (konwersja wewnętrzna). Stąd możliwe są trzy drogi powrotu do stanu podstawowego:
- przejścia promieniste do poszczególnych poziomów ocylacyjnych stanu [math]S_0\;[/math] czyli emisja fluorescencji;
- przejścia bezpromieniste do wysokich stanów oscylacyjnych stanu [math]S_0\;[/math] i szybka relaksacja oscylacyjna w obrębie tego stanu do najniższego poziomu oscylacyjnego;
- przejścia bezpromieniste do układu stanów tripletowych (przejścia międzysystemowe), które pomimo małej różnicy energetycznej między stanami S1 i T1 są procesami bardzo wolnymi, gdyż towarzyszy im zabronione odwrócenie spinu elektronu.
Cząsteczka znajdująca się w stanie [math]T_1\;[/math] może przejść w sposób promienisty do stanu [math]S_0\;[/math] w wyniku emisji fosforescencji lub, w niektórych przypadkach, na skutek aktywacji termicznej ponownie powrócić do stanu [math]S_1\;[/math], a stąd emitując promieniowanie do stanu [math]S_0\;[/math]. Mamy wtedy do czynienia z fluorescencją opóźnioną. Z rysunku Figure 1 wynika, że długości fali promieniowania fluorescencyjnego są większe lub co najwyżej równe długościom fali promieniowania absorbowanego (tzw. przesunięcie Stokesa).
Proces absorpcji promieniowania monochromatycznego o długości fali [math]\lambda\;[/math] w sposób ilościowy opisuje prawo Lamberta–Beera:
gdzie: [math]I0(\lambda)\;[/math] — natężenie promieniowania padającego na próbkę, [math]I(\lambda)\;[/math] — natężenie promieniowania po przejściu przez próbkę, [math]A\;[/math] — absorbancja, czyli wielkość będącą miarą absorpcji, [math]\varepsilon(\lambda)\;[/math] — współczynnik ekstynkcji (absorpcji) molowej substancji absorbującej [M-1cm-1], [math]c\;[/math] — stężenie molowe substancji absorbującej [M], [math]l\;[/math] — długość drogi optycznej [cm].
Z równania (Equation 1) wynika, że absorbancja światła monochromatycznego jest wprost proporcjonalna do stężenia substancji absorbującej oraz do grubości ośrodka, przez który przechodzi promieniowanie.
Natężenie fluorescencji [math]F\;[/math] jest liniową funkcją natężenia promieniowania padającego [math]I_0\;[/math] i wyraża się wzorem:
gdzie: [math]\lambda_\mathrm{wzb}\;[/math] — długość fali wzbudzenia, [math]\lambda_\mathrm{em}\;[/math] — długość fali emisji, [math]c\;[/math] — stężenie molowe substancji emitującej (fluoroforu), [math]\varepsilon(\lambda_\mathrm{wzb})\;[/math] — współczynnik ekstynkcji molowej fluoroforu dla długości fali wzbudzenia, [math]\Phi(\lambda_\mathrm{wzb})\;[/math] — wydajność kwantowa emisji fluorescencji, równa stosunkowi liczby wyemitowanych w drodze fluorescencji kwantów światła do liczby zaabsorbowanych przez próbkę kwantów światła o długości fali [math]\lambda_\mathrm{wzb} \;[/math], [math]f\;[/math] — znormalizowany do jedynki kształt widma emisji fluorescencji.
Dla małych stężeń fluoroforu, gdy absorbancja próbki nie przekracza 0,05 [math](\varepsilon cl \lt 0,05)\;[/math], wyrażenie (Equation 2) opisujące natężenie fluorescencji można przybliżyć równaniem:
z którego wynika, że dla danych wartości długości fali wzbudzającej i emisji oraz ustalonego natężenia promieniowania padającego, natężenie fluorescencji jest wprost proporcjonalne do stężenia substancji emitującej.
W standardowych spektrofluorymetrach obserwuje się najczęściej fluorescencję pod kątem 90° względem wiązki padającej, pochodzącą od fluoroforów znajdujących się w środku geometrycznym kuwety. W miarę wzrostu stężenia próbki natężenie promieniowania docierającego do wnętrza kuwety maleje w skutek coraz większej jego absorpcji, wzrasta też stopień reabsorbcji wyemitowanego promieniowania (pod warunkiem, że próbka pochłania promieniowanie o długości fali równej [math]\lambda_\mathrm{em}\;[/math]). W efekcie tych procesów natężenie fluorescencji przestaje być liniową funkcją stężenia. Zjawisko to nosi nazwę efektu filtra wewnętrznego (ang. inner filter effect).
Aby zrekompensować spadek natężenia fluorescencji wywołany wzrostem absorpcji stosuje się czynniki korekcyjne, których postać zależy od geometrii układu pomiarowego. W standardowym przypadku opisanym powyżej (emisja rejestrowana pod kątem prostym ze środka kuwety) czynnik korekcyjny opisuje wyrażenie:
gdzie [math]A_\mathrm{wzb}\;[/math] i [math]A_\mathrm{em}\;[/math] to wartości absorbancji próbki odpowiednio dla długości fali wzbudzenia i emisji. Natężenie fluorescencji jest wówczas opisane wzorem:
gdzie [math]F_\mathrm{obs}\;[/math] to zmierzone natężenie fluorescencji.
Zależność natężenia fluorescencji od długości fali emisji, przy ustalonej wartości fali wzbudzenia nazywamy widmem emisji fluorescencji, natomiast zależność [math]F(\lambda_\mathrm{wzb})\;[/math] przy ustalonej wartości długości fali emisji to widmo wzbudzenia fluorescencji.
Badania oparte na pomiarach emisji fluorescencji wyróżniają się wysoką czułością — obserwujemy bezpośrednio sygnał emitowany, a nie jak w przypadku pomiarów absorpcyjnych różnicę między sygnałem padającym, a przechodzącym przez próbkę, co ma duże znaczenie w przypadku niskich stężeń badanych próbek. Poza tym, wydajności procesów deaktywacji promienistej i bezpromienistej silnie zależą od różnych czynników środowiskowych (pH, lepkość, temperatura, obecność ligandów, rodzaj solwentu), co czyni fluorescencję cennym narzędziem w badaniach mikrootoczenia fluoroforów.
W przypadku makrocząsteczek biologicznych wykorzystuje się ich właściwości absorpcyjne w obszarze bliskiego nadfioletu i widzialnym (200-800 nm). Za absorpcję w tym zakresie odpowiedzialne są grupy atomów cząsteczki zwane chromoforami. W cząsteczkach białek chromoforami, posiadającymi jednocześnie właściwości fluorescencyjne, są aminokwasy aromatyczne: tryptofan (Trp), tyrozyna (Tyr) i fenyloalanina (Phe). Związki te posiadają pierścienie ze sprzężonym układem węglowych wiązań podwójnych typu [math]\pi\;[/math] (Rys. Figure 2), co powoduje zmniejszenie różnicy energetycznej między poziomami [math] \pi \;[/math] i [math]\pi* \;[/math] i wzrost prawdopodobieństwa przejść [math]\pi\rightarrow \pi* \;[/math] i [math]\pi*\rightarrow \pi \;[/math]. Dla tryptofanu maksimum absorpcji przypada w 278 nm. Położenie maksimum emisji silnie zależy od polarności rozpuszczalnika, w wodzie wynosi ok. 355 nm, w solwentach niepolarnych przesuwa się w stronę krótszych fal. Tyrozyna posiada maksimum absorpcyjne w 274 nm, a położenie pasma emisji (maksimum w 303 nm) nie zależy od polarności otoczenia.
Zasada działania czytnika mikropłytek Infinite 200® PRO
W przypadku pomiarów spektroskopowych z użyciem czytnika mikropłytek, badane próbki umieszcza się w specjalnych płytkach ze studzienkami (dołkami) o objętości rzędu kilka-kilkuset mikrolitrów (Rys. Figure 3). Każda studzienka pełni funkcję mikrokuwety. Najpowszechniej stosowane są płytki 96- oraz 384-dołkowe, ale czytniki mogą być wykorzystywane również do pomiarów płytek 6- i 24-dołkowych (dołki o większej objętości). Urządzenia te znajdują zastosowanie w badaniach biomedycznych, zarówno naukowych, jak i diagnostycznych, wszędzie tam gdzie zachodzi potrzeba szybkich pomiarów dla wielu próbek o małych objętościach. Wśród licznych zastosowań można wymienić m. in. oznaczenia ilościowe DNA/RNA, białek oraz genów reporterowych, badania procesów komórkowych takich jak proliferacja, adhezja i apoptoza, monitorowanie oddziaływań molekularnych typu białko-ligand, białko-białko czy białko-DNA czy pomiary aktywności enzymatycznej.
Czytnik Infinite 200® PRO, na którym wykonasz ćwiczenie pozwala na wykonywanie pomiarów absorpcyjnych w zakresie 230-850 nm (UV/Vis) oraz emisyjnych w zakresie 330-600 nm, ma możliwość wytrząsania płytek i podgrzewania ich w zakresie temperatur od 5°C powyżej temperatury otoczenia do 42°C.
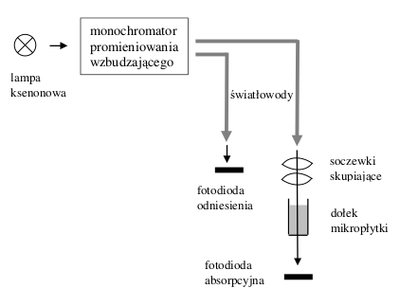
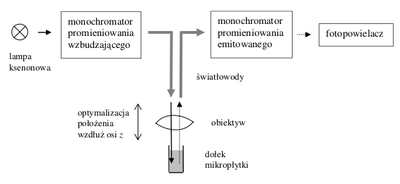
Główne komponenty systemu optycznego czytnika to: ksenonowa lampa błyskowa, dwa podwójne monochromatory (wzbudzenia i emisji), detektor absorpcyjny (fotodioda) oraz emisyjny (fotopowielacz). Na rysunkach Figure 4 i Figure 5 została przedstawiona w sposób schematyczny zasada pomiaru absorpcji (Rys. Figure 4) i fluorescencji (Rys. Figure 5). Skanowanie kolejnych dołków odbywa się dzięki przesuwaniu płytki względem głowicy pomiarowej czytnika. Należy pamiętać, że w przypadku pomiaru w płytce droga optyczna zależy od objętość próbki i kształtu dołka. W eksperymentach ilościowych ważną rolę odgrywa więc precyzja pipetowania.
W celu optymalizacji pomiarów fluorescencyjnych należy dobrać odpowiednie napięcie na fotopowielaczu, poprzez wybór odpowiedniego wzmocnienia (gain), tak by dla próbki o największym natężeniu emisji fotopowielacz pracował w zakresie liniowym. Czytnik posiada też możliwość optymalizacji położenia głowicy pomiarowej wzdłuż osi dołka (z-Position).
Wymagania do kolokwium wstępnego
- Zjawisko absorpcji i emisji promieniowania elektromagnetycznego, prawo Lamberta-Beera, ilościowy opis emisji, efekt filtra wewnętrznego.
- Zasada pomiaru absorpcji i fluorescencji, widmo absorbcji, widma emisji i wzbudzenia fluorescencji.
- Wpływ czynników środowiskowych (temperatura, polarność, pH) na widma absorpcji i fluorescencji.
- Właściwości absorpcyjne i emisyjne aminokwasów.
Przebieg ćwiczenia
Podczas ćwiczenia wykonasz pomiary absorbcji i fluorescencji roztworów wodnych tryptofanu w funkcji jego stężenia oraz dla wybranego stężenia w funkcji temperatury.
Masz do dyspozycji:
- 50 μM roztwór tryptofanu w wodzie (TS),
- wodę dejonizowaną (W),
- 96-dołkową płytkę (12 x 8 dołków) z tworzywa przepuszczającego promieniowanie UV (Greiner UV-Star®),
- parę kwarcowych kuwet absorpcyjnych o długości drogi optycznej 1 cm,
- kwarcową kuwetę fluorescencyjna o długości drogi optycznej 1 cm.
UWAGA! Jeśli nie zaznaczono inaczej każda osoba z grupy przygotowuje własne próbki.
- Przygotuj kolejne rozcieńczenia tryptofanu w wodzie wg poniższego schematu:
- 40 μM Trp (T40) => 0,4 ml H20 + 1,6 ml 50 μM Trp
- 25 μM Trp (T25) => 1 ml H20 + 1 ml 50 μM Trp
- 20 μM Trp (T20) => 1 ml H20 + 1 ml 40 μM Trp
- 15 μM Trp (T15) => 1,4 ml H20 + 0,6 ml 50 μM Trp
- 10 μM Trp (T10) => 1 ml H20 + 1 ml 20 μM Trp
- 7,5 μM Trp (T7) => 1 ml H20 + 1 ml 15 μM Trp
- 5 μM Trp (T5) => 1 ml H20 + 1 ml 10 μM Trp
- 2,5 μM Trp (T2) => 1 ml H20 + 1 ml 5 μM Trp
- 5 μM Trp => 4 ml H20 + 1 ml 25 μM Trp
- Wlej 1 ml 50 μM roztworu Trp (TS) do absorpcyjnej kuwety badanej i 1 ml wody do kontroli. Z pomocą asystenta zarejestruj widmo absorpcji tryptofanu w zakresie 230-350 nm używając spektrofotometru. Jakie jest położenie maksimum widma absorpcji? Wyznacz stężenie próbki Trp na podstawie wartości absorbancji w 278 nm. Współczynnik ekstynkcji tryptofanu w tej długości fali wynosi [math]\varepsilon(278) = \unit{5600}{\frac{1}{Mcm}}\;[/math].
- Kuwetę fluorescencyjną napełnij 3 ml 5 μM roztworu tryptofanu. Z pomocą asystenta zarejestruj widmo emisji fluorescencji tryptofanu w zakresie 290-450 nm dla wzbudzenia w 278 nm używając spektrofluorymetru. Gdzie zaobserwowałeś maksimum widma emisji?
- Zapoznaj się z zasadą obsługi czytnika mikropłytek
- Napełnij dołki płytki przygotowanymi wcześniej roztworami tryptofanu (pkt. 1)
wg poniższego schematu. Dodaj po 300 μl do każdego dołka.
1 2 3 4 5 6 7 8 9 10 11 12 A W T2 T5 T7 T10 T15 T20 T25 T40 TS W – B – – – – – – – – – – – – C W T2 T5 T7 T10 T15 T20 T25 T40 TS W – Rząd A napełnia pierwsza osoba z grupy, rząd C druga.
- Przeprowadź pomiar absorbancji w 278 nm oraz natężenia fluorescencji w 355 nm dla wzbudzenia w 278 nm dla dołków A1-A12 oraz C1-C12. Przed pomiarem dobierz odpowiednie wzmocnienie na fotopowielaczu na podstawie pomiarów dla dołka z najwyższym stężeniem Trp (gain => calculated from well A10 lub C10) oraz dokonaj optymalizacji położenia głowicy czytnika (z-Position). Liczbę błysków lampy przypadającą na pomiar jednego dołka (number of flashes) ustaw równą 10. Wyniki pomiarów posłużą Ci do zbadania zależności absorbancji i natężenia fluorescencji od stężenia próbki.
- Dla próbek tryptofanu o stężeniu 10 μM (dołki A5 i C5) przeprowadź analogiczne pomiary absorpcyjne i emisyjne jak w punkcie 6 w funkcji temperatury, od ok. 20-25°C do 40°C, co 5°C. Dobierz odpowiednie napięcie na fotopowielaczu, a ustawienie z-position pozostaw takie jak w punkcie 6. Wyniki pomiarów posłużą Ci do wyznaczenia zależności absorbancji i natężenia fluorescencji od temperatury.
Opis końcowy
Opis końcowy powinien zawierać poszczególne elementy charakterystyczne dla raportu z przebiegu eksperymentu (streszczenie, wstęp teoretyczny, opis układu doświadczalnego oraz wyniki i ich dyskusję).
Wyniki należy opracować korzystając z programu ORIGIN lub PRISM (dostępne na komputerach w Pracowniach Komputerowych w Zakładzie Biofizyki i w sali 112 w budynku dydaktycznym przy ul. Pasteura 7) i udokumentować za pomocą czytelnych tabel i wykresów.
Opracowanie wyników powinno uwzględniać następujące zagadnienia:
- Analizę i interpretację zależności absorbancji i natężenia fluorescencji (również po uwzględnieniu efektu filtra wewnętrznego – wzór 5) od stężenia tryptofanu (pomiary z pkt. 6).
- Wyznaczenie stężenia tryptofanu w poszczególnych próbkach (pomiary z pkt. 6) i porównanie ich z wartościami nominalnymi. Współczynnik ekstynkcji tryptofanu w 278 nm wynosi [math]\varepsilon(278) = \unit{5600}{\frac{1}{ Mcm}}\;[/math], droga optyczna przy objętości próbki 300 μl jest równa l = 0,84 cm.
- Analizę i interpretację zależności absorbancji i natężenia fluorescencji od temperatury (pomiary z pkt. 7).
Przy opracowywaniu danych pamiętaj o odjęciu tła pochodzącego od rozpuszczalnika (nie dotyczy to czynnika korekcyjnego dla filtra wewnętrznego).
Literatura
- „Biofizyka. Wybrane zagadnienia wraz z ćwiczeniami”, red. Z. Jóźwiak i G. Bartosz, PWN 2007
- „Spektroskopia molekularna”, J. Sadlej, WNT 2002
- „Podstawy spektroskopii molekularnej”, Z. Kęcki, PWN 1998
- „Principles of fluorescence spectroscopy” J.R. Lakowicz