Chemia organiczna/Węglowodory aromatyczne
Spis treści
WĘGLOWODORY AROMATYCZNE.
Węglowodorami aromatycznymi nazwano związki, które zawierają stosunkowo mało wodoru, co wskazywałoby na ich nienasycony charakter, jednak w reakcjach wykazują mniejszą aktywność i ulegają przede wszystkim reakcjom substytucji (podobnie do mało reaktywnych alkanów), a nie reakcjom addycji (charakterystycznym dla związków nienasyconych). Ich charakterystyczną cechą fizyczną jest intensywny zapach, stąd właśnie bierze się ich nazwa.
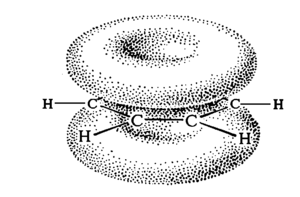
Historycznie, zagadnienie aromatyczności (tu i dalej w znaczeniu już nie właściwości zapachowych, ale charakterystycznych właściwości chemicznych) budziło dużo kontrowersji, gdyż nie można było ustalić wzoru strukturalnego, który opisywałby poprawnie budowę cząsteczki. W świetle teorii orbitali molekularnych struktura cząsteczki benzenu — podstawowego układu aromatycznego — wygląda następująco:
Benzen ma wzór ogólny C6H6. Każdy z sześciu atomów węgla wykazuje hybrydyzację [math]sp^2[/math] i tworzą one układ płaski o kątach C—C—C i H—C—C wynoszących 120°. Sześć niezhybrydyzowanych orbitali atomowych p tworzy orbital zdelokalizowany obejmujący swym zasięgiem wszystkie sześć atomów węgla. Wszystkie wiązania C—C są równocenne, a ich długość wynosi 0,139 nm (wartość większa od długości wiązania podwójnego C=C).
W nowszej literaturze najczęściej wzór strukturalny benzenu i jego pochodnych rysuje się jako sześciokąt z okręgiem w środku. Ten okrąg symbolizuje wiązanie zdelokalizowane [math]\pi[/math] charakterystyczne dla układu aromatycznego i jest rysowany ciągłą bądź przerywaną linią. Można rysować wzór benzenu również jako 1,3,5-cykloheksatrien, ale należy przy tym pamiętać, że taki zapis nie odzwierciedla wyjątkowej budowy pierścienia aromatycznego.
Należy dodać, że nie każdy układ cykliczny z naprzemiennym występowaniem wiązań podwójnych i pojedynczych wykazuje właściwości aromatyczne. Aby można było mówić o aromatyczności związku musi być spełnionych kilka warunków. Przede wszystkim układ cykliczny powinien być płaski. Po drugie liczba elektronów niezhybrydyzowanych p musi spełniać tzw. regułę Hückla ([math]4n + 2[/math] elektronów, gdzie n jest liczbą naturalną). Do tego zagadnienia wrócimy jeszcze przy omawianiu związków heterocyklicznych. Na Rys. Figure 2. podane są wzory węglowodorów cyklicznych, które nie wykazują właściwości aromatycznych, gdyż nie spełniają wszystkich warunków aromatyczności.

|
1,3-cyklobutadien |

|
1,3,5,7-cyklooktatetraen |

|
1,3,5,7,9-cyklodekapentaen |
Budowa i nomenklatura węglowodorów aromatycznych
Wiele zwyczajowych nazw związków aromatycznych zostało przyjętych przez nazewnictwo systematyczne. Wybrane przykłady podaje Rys. Figure 3. Nazwy węglowodorów z krótkimi łańcuchami bocznymi tworzy się dodając odpowiednie przedrostki przed nazwą benzenu, np. etylobenzen, n-propylobenzen itp. W niektórych przypadkach podyktowanych wygodą za podstawę nazwy przyjmuje się alkan (-en, -in), a pierścień benzenu traktuje się jako podstawnik i nazywa grupą fenylową.

|
benzen | 
|
toluen |
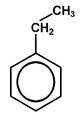
|
etylobenzen | 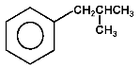
|
izobutylobenzen |
|
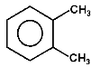
o-ksylen | 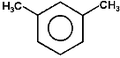
|
m-ksylen |
|
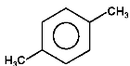
p-ksylen | 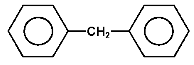
|
difentylometan |
|
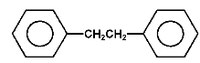
1,2-difenyloetan | 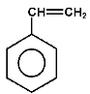
|
winylobenzen (styren) |
|
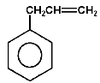
allilobenzen (3-fenylopropen) | 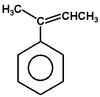
|
2-fenylobut-2-en |
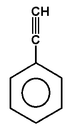
|
fenyloacetylen (fenyloetyn) |
Na Rys. Figure 3. dla dimetylowych pochodnych benzenu (ksylenów) pojawiła się izomeria położenia. Ogólnie dipodstawione benzeny występują w postaci trzech izomerów: orto (podstawienie 1,2, podstawniki przy sąsiednich atomach węgla), meta (podstawienie 1,3) i para (podstawienie 1,4). W samych nazwach takich izomerów wystarczy podawać tylko pierwszą literę właściwego przedrostka: o-, m-, lub p-.
We wzorach skróconych resztę fenylową zaznacza się jako C6H5— bądź stosuje się skrót Ph albo [math]\Phi[/math]. Gdy chce się zaznaczyć obecność pierścienia aromatycznego bez precyzowania jego struktury stosuje się skrót ogólny "Ar", na ogół dla odróżnienia od reszty alifatycznej, którą jak już wiemy oznaczamy jako "R".
Poza układem benzenu znanych jest wiele związków wielopierścieniowych, które również wykazują właściwości aromatyczne. Ich najprostsze przykłady pokazane są na Rys. Figure 4. Należy zauważyć, że dla tych układów raczej nie stosuje się wzorów z kółkiem, ale zaznacza się umowne wiązania podwójne. Zresztą dla tych bardziej skomplikowanych pod względem rozkładu gęstości elektronowej aromatycznych orbitali zdelokalizowanych, ani jedna ani druga wersja wzoru nie oddaje poprawnie budowy związków.

|
naftalen |

|
fenantren |

|
bifenyl |
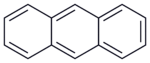
|
antracen |

|
fluoren |
W przypadku bardziej rozbudowanych związków, aby łatwiej posługiwać się nazwami chemicznymi, warto zapoznać się z powszechnie używanymi nazwami grup (reszt, podstawników) wywodzących się z węglowodorów aromatycznych. Przykłady najprostszych z nich są pokazane na Rys. Figure 4.
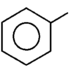
|
fenyl |
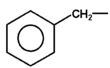
|
benzyl |
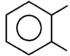
|
fenylen (izomer orto) |
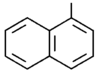
|
1-naftyl |
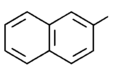
|
2-naftyl |
Efekt mezomeryczny
W prostym ujęciu termodynamicznym mówi się, że struktura benzenu i jego analogów jest trwała, ponieważ delokalizacja elektronów obniża znacznie energię wewnętrzną. Różnica energii wewnętrznej hipotetycznego 1,3,5-cykloheksatrienu i benzenu wynosi 151 kJ/mol. W języku chemicznym nazywa się to stabilizacją mezomeryczną.
O mezomerii lub efekcie mezomerycznym mówi się wtedy, gdy może powstać wiązanie zdelokalizowane i tworzy się układ o energii wewnętrznej mniejszej niż obliczona dla struktury wynikającej z jakiegokolwiek wzoru strukturalnego możliwego do zaproponowania dla danego układu. Mezomeria związana jest immanentnie z obecnością elektronów [math]\pi[/math] i innych elektronów, które mogą się z nimi sprzęgać. Mezomeria może występować w cząsteczkach obojętnych elektrycznie, w jonach oraz w wolnych rodnikach. Układ mezomeryczny nie daje się opisać zwykłym wzorem strukturalnym. Jeżeli chcemy opisać strukturę takiego układu rysujemy tzw. struktury graniczne, których superpozycja (z uwzględnieniem wagi statystycznej poszczególnych form) daje dopiero obraz właściwości chemicznych układu. Na przykład strukturę benzenu opisujemy w sposób przedstawiony na Rys. Figure 6.
Należy dodać, że efekt mezomeryczny jest pojęciem sztucznym, a nie realnym oddziaływaniem międzyatomowym, jak to jest w przypadku efektu indukcyjnego i sterycznego. Służy on tylko do wyjaśniania tych właściwości związków, których nie możemy wywnioskować z klasycznego zapisu wzoru strukturalnego. Mezomeria w podręcznikach tłumaczonych z języka angielskiego (USA) nazywana jest rezonansem.
Substytucja elektrofilowa w układach aromatycznych
Profil energetyczny reakcji.
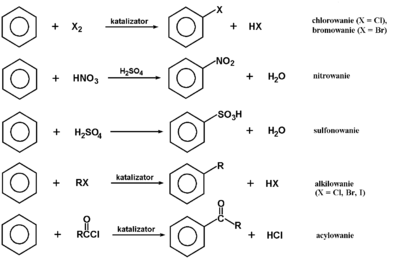
Najbardziej charakterystyczną reakcją benzenu i ogólnie pierścieni aromatycznych jest substytucja (podstawienie) atomu wodoru przez inny atom lub grupę atomów. Przykłady najczęściej wykonywanych syntez przedstawia poniższy Schemat Figure 7.
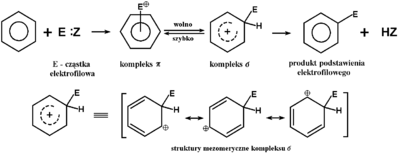
Reakcje te określamy jako elektrofilowe, ponieważ odczynnikiem atakującym w pierwszym stadium reakcji jest cząstka o charakterze elektrododatnim, wchodząca w oddziaływanie z elektronami [math]\pi[/math] pierścienia aromatycznego (porównaj reakcje alkenów). Kompletny mechanizm reakcji substytucji elektrofilowej jest podany na poniższym Schemacie Figure 8.
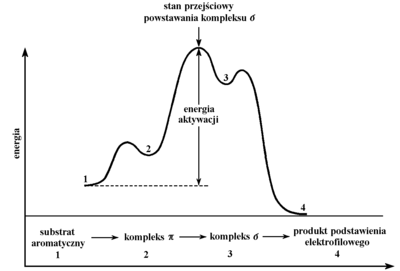
Jeżeli cząstka elektrofilowa w kompleksie [math]\pi[/math] utworzy wiązanie kowalencyjne z jednym z atomów węgla w benzenie, wtedy powstaje inny stan pośredni — kompleks [math]\sigma[/math]. Dalej, najkorzystniejszym przekształceniem kompleksu [math]\sigma[/math] jest powrót do układu aromatycznego, przy czym łatwiej rozerwaniu ulega wiązanie C—H niż C—E i powstaje produkt podstawienia. Przybliżone relacje energetyczne w trakcie reakcji pokazuje poniżej Rys. Figure 9.
Porównując ponownie tę reakcję z atakiem odczynników elektrofilowych na alkeny, należy zauważyć różnicę w końcowym etapie obu reakcji. W tamtym przypadku karbokation w stanie pośrednim przyłączał cząstkę elektroujemną ze środowiska reakcji i w efekcie następowała reakcja przyłączenia, podczas gdy tu ze względu na dużą stabilizację mezomeryczną układu aromatycznego korzystniejsze energetycznie jest oddysocjowanie protonu od kompleksu [math]\sigma[/math].
Podobnie jak to pokazano na Rys. Figure 9. wyglądają profile energetyczne większości reakcji organicznych. Najistotniejszym elementem reakcji jest dostarczenie energii potrzebnej do rozerwania wybranego wiązania chemicznego, którą nazywa się energią aktywacji. Najczęściej energię dostarcza się w postaci ciepła, a inne warunki reakcji dobiera eksperymentalnie tak, aby powstawał głównie pożądany produkt. Ze względu bowiem na nieduże nieraz różnice energii dysocjacji różnych wiązań w tej samej cząsteczce i możliwości różnego przekształcenia kompleksów pośrednich, w wyniku reakcji organicznej mogą powstawać różne produkty z tych samych substratów. W dalszym toku wykładu poznamy wiele przykładów ilustrujących powyższe stwierdzenie.
Substytucja elektrofilowa w alkilowych pochodnych benzenu.
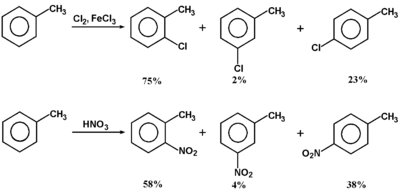
Rozpatrzmy przykłady reakcji podanych na poniższym Schemacie Figure 10.
Zauważamy:
- Reakcje substytucji następują tylko w pierścieniu aromatycznym, podczas gdy reszta alkilowa pozostaje nienaruszona. Pokazane na rysunku reakcje przebiegają według mechanizmu jonowego (właściwym odczynnikiem elektrofilowym jest silnie spolaryzowany kompleks FeCl4—Cl, a więc praktycznie jon Cl⊕ w przypadku chlorowania, oraz NO2⊕ w przypadku nitrowania), a takie odczynniki nie są w stanie rozerwać wiązania C—H w reszcie węglowodoru nasyconego. Innymi słowy warunki podanych na Schemacie Figure 10. reakcji są wystarczające do pokonania bariery aktywacji podstawienia elektrofilowego w pierścieniu aromatycznym, ale dostarczają zbyt mało energii do pokonania bariery aktywacji podstawienia atomu wodoru w układzie alifatycznym.
- Produktami reakcji są dipodstawione pochodne benzenu, więc mogą się tworzyć trzy różne izomery podstawienia: orto, meta i para. Podane na rysunku stosunki wydajności poszczególnych izomerów odbiegają znacznie od przewidywanych na podstawie ściśle statystycznej (odpowiednio: 40, 40 i 20%). Obserwowany kierunek podstawienia drugiego podstawnika w pierścieniu benzenu tłumaczy się wpływem dwóch efektów. Pierwszy to efekt indukcyjny grupy metylowej w kompleksie pośrednim [math]\sigma[/math], stabilizujący ten kation w przypadku podstawienia orto i para, a nie działający w przypadku podstawienia meta. Drugi to efekt steryczny, powodujący utrudniony atak odczynnika elektrofilowego na pozycję orto. Dlatego, czym większa objętościowo jest grupa alkilowa w substracie i czym większa jest cząstka atakująca, tym mniej powstaje izomeru orto, a więcej izomeru para.
- Następne pytanie to, czy w alkilowych pochodnych benzenu substytucja elektrofilowa następuje łatwiej czy trudniej niż w samym benzenie. Wyniki doświadczeń mówią, że toluen i inne alkilowe pochodne benzenu reagują szybciej niż sam benzen (toluen około 25 razy szybciej niż benzen). O takim podstawniku w pierścieniu aromatycznym, który ułatwia przebieg reakcji podstawienia elektrofilowego chemicy mówią, że jest grupą aktywującą. We względnej klasyfikacji podstawników w układach aromatycznych grupy alkilowe uważa się za słabo aktywujące (ogólnie znane są grupy silnie aktywujące, słabo aktywujące, słabo dezaktywujące i silnie dezaktywujące — będziemy je poznawać w dalszym toku wykładu). Fakt aktywacji pierścienia tłumaczy się efektem indukcyjnym grupy alkilowej, który w substracie zwiększa gęstość elektronową wiązania [math]\pi[/math] w pierścieniu aromatycznym i ułatwia tworzenie się kompleksu [math]\pi[/math], oraz następnie obniża znacznie energię aktywacji tworzenia kompleksu [math]\sigma[/math] (w przypadku ataku na pozycje orto i para), co zostało już opisane w poprzednim punkcie.
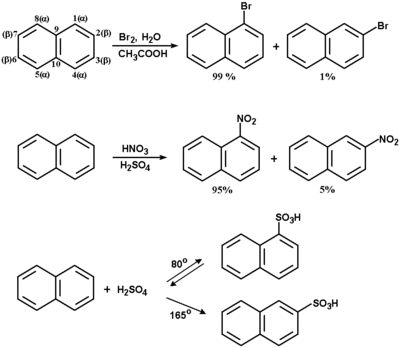
Substytucja elektrofilowa w naftalenie.
Naftalen reaguje w warunkach podstawienia elektrofilowego podobnie do benzenu, i to nawet łatwiej od niego. Spośród dwu możliwych izomerów w przewadze tworzy się produkt podstawienia w pozycji 1 (pozycja określana również jako [math]\alpha[/math]). Fakt ten tłumaczy się dużo niższą energią aktywacji powstawania kompleksu [math]\sigma[/math] z podstawnikiem w pozycji 1 niż analogicznego kompleksu [math]\sigma[/math] z podstawnikiem w pozycji 2 (pozycja [math]\beta[/math]). W niektórych
przypadkach, gdy poszczególne etapy reakcji są łatwo odwracalne, możliwe jest otrzymanie produktu z podstawnikiem w pozycji 2. Pochodna naftalenu z grupą w położeniu [math]\beta[/math] ma z przyczyn sterycznych mniejszą energię wewnętrzną niż pochodna [math]\alpha[/math]. A zatem jeżeli zmienimy warunki reakcji tak, aby energia aktywacji powstawania kompleksu [math]\sigma[/math] z podstawnikiem w pozycji 2 (np. podwyższymy temperaturę reakcji) mogła być dostarczona, głównym produktem będzie związek termodynamicznie trwalszy, czyli izomer [math]\beta[/math]. Przykłady reakcji podstawienia elektrofilowego w naftalenie są pokazane na Schemacie Figure 11.
Inne reakcje benzenu i jego pochodnych.
Oprócz podstawienia w pierścieniu aromatycznym, benzen i jego pochodne mogą reagować w inny sposób, np.:
- Pierścień aromatyczny może być zredukowany w reakcji wodorowania (wodór pod wysokim ciśnieniem wobec katalizatora). W takich warunkach z benzenu można otrzymać cykloheksan.
- Alifatyczny łańcuch boczny w benzenie może być utleniony (i jednocześnie zdegradowany) do grupy karboksylowej. Bez względu na długość łańcucha bocznego z monopodstawionego benzenu otrzymuje się kwas benzoesowy (C6H5COOH).
- Mogą następować reakcje charakterystyczne dla podstawnika, np. z toluenu z chlorem w obecności silnego światła może się tworzyć chlorek benzylu (C6H5CH2Cl), czyli następować reakcja wolnorodnikowego podstawienia w reszcie alkilowej.
Źródła węglowodorów aromatycznych.
Głównym, naturalnym źródłem węglowodorów aromatycznych jest tzw. smoła pogazowa uzyskiwana w wyniku suchej destylacji węgla kamiennego w koksowniach i gazowniach. Źródło to obecnie traci na znaczeniu, ponieważ jako gaz opałowy stosuje się coraz częściej gaz ziemny, a dawne gazownie są zamykane. Węglowodory aromatyczne występują również w ropie naftowej, ale na ogół nie są z niej wyodrębniane. Zapotrzebowanie na te węglowodory jest dość duże, ponieważ stanowią surowce wielu gałęzi przemysłu chemicznego (barwniki, polimery, farmaceutyki). Obecnie więc przeważająca większość węglowodorów aromatycznych jest produkowana syntetycznie z ropy naftowej w procesie reformingu (aromatyzacji).