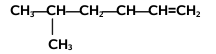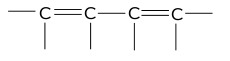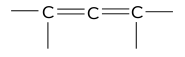Chemia organiczna/Alkeny
Spis treści
Budowa i nazewnictwo alkenów
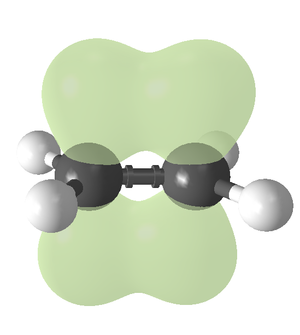
W rozdziałach — poprzednim i jeszcze wcześniejszym, poznaliśmy węglowodory, w których budowie występowały tylko wiązania pojedyncze, czyli były one utworzone z atomów węgla o hybrydyzacji [math]sp^3[/math]. Wiadomo jednak, że atomy węgla mogą przybierać innego typu hybrydyzację i tworzyć wiązania wielokrotne. Tytułowe alkeny to węglowodory zawierające przynajmniej dwa sąsiednie atomy węgla o hybrydyzacji [math]sp^2[/math] i tworzące wiązanie podwójne C=C. Bardziej ogólnie węglowodory zawierające wiązania wielokrotne nazywa się węglowodorami nienasyconymi. Budowę wiązania podwójnego na przykładzie najprostszego alkenu, etenu przedstawia poniższy Rys. Figure 1.
Rysunek należy rozumieć w ten sposób, że w etenie atomy węgla oraz związane z nimi cztery atomy wodoru leżą w jednej płaszczyźnie, kreski łączące atomy obrazują wiązania [math]\sigma[/math], a elektrony wiązania [math]\pi[/math] tworzą chmury elektronowe (orbital [math]\pi[/math]) nad i pod tą płaszczyzną. Kąty wiązań C—C—H i H—C—H wynoszą po ok. 120°, a długość wiązania C=C — 0,134 nm. Wzór ogólny alkenów (z jednym podwójnym wiązaniem) to [math]\mathrm C_n\mathrm H_{2n}[/math]. Łatwo zauważyć, że alkeny i poprzednio omówione cykloalkany (mowa oczywiście o monocyklicznych węglowodorach) mogą być izomerami.
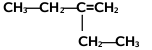
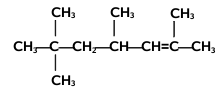
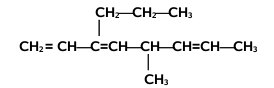
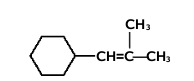
Nazwy alkenów tworzymy na kanwie nazw węglowodorów nasyconych zmieniając tylko końcówkę -an na -en. Począwszy od alkenu czterowęglowego, butenu, musimy zaznaczać również położenie wiązania podwójnego w łańcuchu węglowym, umieszczając przed końcówką -en odpowiedni lokant, np. but-2-en, oznaczający numer atomu węgla, od którego zaczyna się podwójne wiązanie[1]. Poza tym obowiązują takie same reguły, jak w przypadku nazewnictwa alkanów, podane w rozdziale o alkanach, przy czym należy pamiętać, że łańcuch główny powinien zawierać atomy węgla zaangażowane w wiązaniu podwójnym, nawet jeżeli nie jest to najdłuższy łańcuch w cząsteczce danego węglowodoru. Jeżeli w cząsteczce znajduje się dwa lub więcej wiązań podwójnych, to ich obecność zaznaczamy odpowiednimi lokantami, a w końcówce nazwy podajemy ich wielokrotność, np. -dien, -trien, -tetraen itd. Podane na Rys. Figure 2. przykłady obrazują tworzenie nazw systematycznych alkenów. W przypadku niższych alkenów częściej używane są nazwy zwyczajowe, jak np. etylen, propylen czy izobutylen.
Wspomniane dopiero co niskocząsteczkowe alkeny są produkowane w przemyśle chemicznym w ilości sięgającej stu milionów ton rocznie w skali światowej z ropy naftowej w procesie krakingu termicznego. Znajdują one szerokie zastosowanie do produkcji tworzyw sztucznych (kauczuk syntetyczny, polietylen, polipropylen) i innych produktów organicznych.
Wokół wiązania podwójnego nie istnieje swobodny obrót. Obrót oznaczałby rozerwanie wiązania [math]\pi[/math], co w zwykłych warunkach w temperaturze pokojowej jest niemożliwe. Rozerwanie wiązania [math]\pi[/math] wymaga bowiem dostarczenia ok. 235 kJ/mol. Wartość ta jest o rząd wielkości większa niż bariery rotacji w alkanach. Dlatego dla dipodstawionych alkenów istnieją dwa izomery geometryczne cis i trans[2], jak pokazano przykładowo na Rys. Figure 3.

|

| |
| cis-but-2-en | trans-but-2-en | |
| wrzenie | 4° | 1° |
| topnienie | -139° | -106° |
Dieny
Rozróżnia się trzy typy dienów: izolowane, sprzężone (skoniugowane) i skumulowane. Dieny izolowane to węglowodory nienasycone zawierające dwa wiązania podwójne oddalone od siebie o przynajmniej dwa wiązania pojedyncze. Pod względem chemicznym zachowują się one jak zwykłe alkeny. W dienach sprzężonych wiązania podwójne oddzielone są tylko jednym wiązaniem pojedynczym:
W takim związku wszystkie cztery sąsiadujące ze sobą atomy węgla wykazują hybrydyzację [math]sp^2[/math], czyli mają niezhybrydyzowany orbital p. Wbrew sytuacji wynikającej z podanego wzoru strukturalnego orbitale p dwu środkowych atomów węgla też mogą ze sobą oddziaływać (nakrywać się). Rzeczywiście stwierdzono w 1,3-butadienie i układach analogicznych istnienie orbitalu zdelokalizowanego obejmującego swoim zasięgiem wszystkie cztery atomy węgla. Obrazowo mówiąc każdy z czterech elektronów, biorących udział w wiązaniu sprzężonym, może znaleźć się w sferze oddziaływania każdego z czterech atomów węgla. Wynika stąd kilka wniosków. Po pierwsze wiązanie środkowe C—C wykazuje w pewnym stopniu charakter wiązania podwójnego, jest o ok. 0,005 nm krótsze od zwykłego wiązania C—C. Po drugie podany wyżej zapis strukturalny dienu nie oddaje poprawnie jego budowy elektronowej, a co za tym idzie jego reaktywności. Bo właśnie, po trzecie, związki zawierające układy sprzężone w wielu testach chemicznych i fizykochemicznych zachowują się specyficznie, inaczej niż związki zawierające izolowane wiązania podwójne.
Wreszcie przyjrzyjmy się pobieżnie trzeciemu układowi dienowemu. W dienach skumulowanych, zwanych też allenami:
środkowy atom węgla posiada hybrydyzację sp, a więc odróżnia się pod względem hybrydyzacji od dwu pozostałych. Dodajmy też, że cały układ siedmiu związanych ze sobą atomów (w przypadku najprostszego przedstawiciela, allenu, są to trzy atomy węgla i cztery atomu wodoru) nie jest płaski, gdyż wiązania C-podstawniki przy dwóch skrajnych atomach węgla leżą w płaszczyznach do siebie prostopadłych.
Wzory szkieletowe
Wśród poznanych dotychczas metod odwzorowania budowy związków organicznych spotkaliśmy się z wzorami sumarycznymi, np. C4H8, wzorami strukturalnymi, wzorami skróconymi (np. CH3CH2CH2CH3), wzorami perspektywicznymi (w tym z wzorami Hawortha), wzorami Newmana i konformacyjnymi. Tymi różnymi wzorami posługujemy się w zależności od potrzeb, w zależności od tego elementu własności związku, który akurat chcemy wyeksponować. Nieraz wystarcza nam wzór sumaryczny, nieraz wprowadzamy symbole ogólne, jak np. R w miejsce jakiejkolwiek grupy alkilowej, nieraz musimy zastosować wzór skrócony, bo wzór sumaryczny byłby niewystarczający, a często należy zapisać cały wzór strukturalny lub nawet któryś ze wzorów przestrzennych.
Najczęściej posługujemy się tzw. wzorami szkieletowymi, w których zaznacza się w sposób uproszczony łańcuch węglowy, a pomija się rysowanie atomów wodoru. W pokazanych tu dotychczas wzorach strukturalnych rysowaliśmy cząsteczki tak, jakby były płaskie o kątach prostych między wiązaniami. W rzeczywistości budowa związków jest przestrzenna. Przy atomach węgla o hybrydyzacji [math]sp^3[/math] wiązania rozmieszczone są tetraedrycznie, a wokół atomów węgla o hybrydyzacji [math]sp^2[/math] kąty wiązań wynoszą ok. 120°. We wzorach szkieletowych staramy się naśladować te cechy budowy związków. Jednocześnie wzory szkieletowe dzięki opuszczeniu atomów wodoru zyskują na przejrzystości.
Poniżej podano przykłady wzorów szkieletowych. Od tej pory będziemy je często stosować zamiast nienaturalnych "płaskich" wzorów.
| n-butan | 50px | izobutan (2-metylopropan) | |
| n-pentan | 50px | neopentan (2,2,-dimetylopropan) | |
| trans-but-2-en | 50px | buta-1,3-dien | |
| 30px | izobuten (2-metylopropen) | 100px | 3-winylopenta-1,4-dien |
Reakcje chemiczne
Charakterystyczny fragment budowy cząsteczki, określający jednocześnie właściwości chemiczne związku organicznego nazywa się grupą funkcyjną. W alkenach taką grupą funkcyjną jest właśnie wiązanie podwójne węgiel-węgiel. Wiązanie podwójne C=C, a ściślej wiązanie [math]\pi[/math] w nim zawarte jest podatne na rozerwanie, mówimy zatem że wykazuje ono dużą reaktywność chemiczną. Reaktywność tego wiązania wynika stąd, że elektrony zajmujące orbital [math]\pi[/math] znajdują się dalej od atomów węgla i są słabiej z nimi związane, a więc bardziej ruchliwe niż elektrony wiązań [math]\sigma[/math] i łatwiej dostępne dla zbliżających się reagentów.
Reakcje addycji elektrofilowej
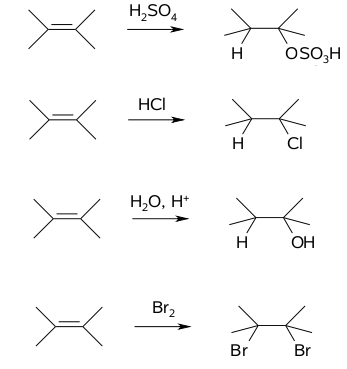
Wobec powyższego zrozumiałym wydaje się fakt, że czynniki najłatwiej atakujące elektrony wiązania [math]\pi[/math] mają charakter elekrododatni. W chemii organicznej tego typu cząstki nazywamy odczynnikami elektrofilowymi, czyli wykazującymi powinowactwo do elektronów. Najczęściej jest to po prostu proton pochodzący z kwasu, ale może być też związek z luką elektronową lub cząsteczka ulegająca łatwo spolaryzowaniu podczas zbliżenia się do elektronów [math]\pi[/math]. Przykłady reakcji alkenów z udziałem odczynników elektrofilowych podaje poniżej Rys. Figure 4. Reakcje te przebiegają więc według mechanizmu jonowego (podobnie jak w przypadku omawianych już reakcji cyklopropanu, a inaczej niż w przypadku reakcji wolnorodnikowych) i określa się je jako reakcje addycji elektrofilowej (addycja to inaczej reakcja przyłączania).
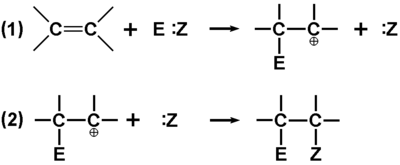
Uogólniony przebieg reakcji według mechanizmu addycji elektrofilowej podaje poniższy Rys. Figure 5., gdzie E oznacza elektrofilowy fragment reagenta, a :Z fragment elektroujemny.
Reakcja addycji elektrofilowej jest dwuetapowa. W pierwszym etapie odczynnik elektrofilowy zbliża się do orbitalu [math]\pi[/math] i przechwytuje elektrony tego wiązania, tworząc nowe wiązanie pojedyncze C—E (np. C—H; trzeba tu zaznaczyć, że nie każdy czynnik elektrododatni zdolny jest utworzyć trwałe wiązanie, a więc za właściwy odczynnik elektrofilowy uważa się tylko taki element elektrodotani, który może tworzyć stabilne wiązanie z atomem węgla). W stanie przejściowym tworzy się karbokation z deficytem elektronowym na sąsiednim do zaatakowanego atomie węgla. Taki karbokation jest bardzo reaktywny i szybko atakuje inne obiekty zdolne do oddania (uwspólnienia) elektronów. O szybkości reakcji wieloetapowej decyduje zawsze etap najwolniejszy. W naszym przypadku jest to etap (1), dlatego dla zaznaczenia istoty reakcji określamy jej mechanizm jako elektrofilowy. Na marginesie zwróćmy jeszcze uwagę, że w trakcie tych reakcji atomy węgla zmieniają swój stan hybrydyzacji z [math]sp^2[/math] na [math]sp^3[/math].
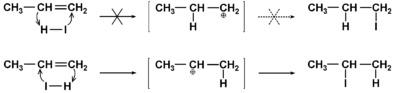
W przypadku reakcji odczynnika niesymetrycznego, np. jodowodoru (HI), z alkenem niesymetrycznym, np. propenem, teoretycznie możliwe jest powstanie dwu różnych izomerów. Uprzywilejowany kierunek reakcji podaje Rys. Figure 6. Zakrzywione strzałki na tym schemacie oznaczają kierunek przesunięcia elektronów w trakcie rozrywania wiązania [math]\pi[/math]
i tworzenia się nowych wiązań z atomami węgla. O kierunku addycji decyduje reguła Markownikowa, od nazwiska rosyjskiego chemika z XIX w. Mówi ona, że atom wodoru przyłącza się do atomu węgla związanego z większą liczbą atomów wodoru. Uogólniona formuła tej reguły mówi, że elektrofilowy element reagenta przyłącza się do atomu węgla mniej rozgałęzionego. Na gruncie budowy elektronowej fakt ten wyjaśnia się większą trwałością (niższy poziom energii wewnętrznej, niższa energia aktywacji wymagana do tworzenia z substratu) tego kationu w stanie pośrednim, którego ładunek dodatni umiejscowiony jest na bardziej rozgałęzionym atomie węgla.
Większą trwałość bardziej rozgałęzionego karbokationu tłumaczy się z kolei w oparciu o tzw. efekt indukcyjny. W tym przypadku oznacza to, że elektrony ze stosunkowo dużej i polaryzowalnej grupy alkilowej (np. —CH3) mogą się przesunąć w kierunku pobliskiego ładunku dodatniego łatwiej niż elektrony z atomu wodoru. Zatem im więcej jest grup alkilowych przyłączonych do dodatnio naładowanego atomu węgla, tym bardziej ten ładunek jest równoważony (innymi słowy rozmywany na inne atomy węgla), co w efekcie daje względną stabilizację karbokationu. Efekty indukcyjne różnych grup funkcyjnych często są wykorzystywane w chemii organicznej do wyjaśniania różnic w reaktywności związków, dlatego będziemy o nich nieraz jeszcze mówić.
Reakcje addycji wolnorodnikowej oraz utleniania i redukcji
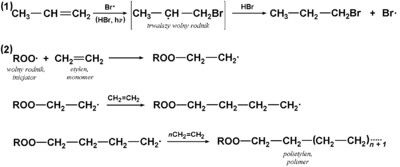
W wielu reakcjach alkenów stwierdza się jednak niezgodny z regułą Markownikowa kierunek przyłączania. Dokładniejsze badania wskazują, że w takich przypadkach reakcje przebiegają według innego mechanizmu. Bowiem elektrony wiązania [math]\pi[/math] mogą zostać zaatakowane również przez wolne rodniki, z utworzeniem wiązania węgiel-cząstka atakująca i powstaniem nowego wolnego rodnika z niesparowanym elektronem przy sąsiednim atomie węgla. Przykładowe reakcje przebiegające według mechanizmu wolnorodnikowego podaje poniżej Rys. Figure 7.
Reakcje na Rys. Figure 7. mają charakter łańcuchowy. Reakcja (2) to polimeryzacja wykorzystywana w przemyśle chemicznym na dużą skalę.
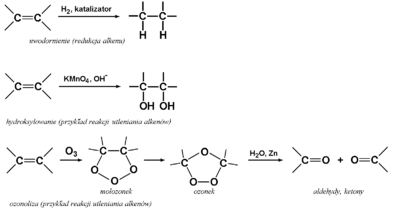
Reakcje utleniania i redukcji alkenów, w trakcie których w stanach pośrednich tworzą się kompleksy cykliczne elektronów [math]\pi[/math] z odpowiednimi reagentami, podaje poniższy Rys. Figure 8.
Reakcje podstawienia w pozycji allilowej.
Większość alkenów zawiera oprócz wiązania podwójnego również reszty alkilowe, czyli fragmenty strukturalne charakterystyczne dla alkanów. Oczywiście grupy te mogą w określonych warunkach reagować tak jak alkany. My jednak omawiając kolejne nowe grupy funkcyjne będziemy zwracać zasadniczo uwagę na reakcje charakterystyczne tylko dla danej grupy. Ale zawsze należy pamiętać o tym, że obecność grupy funkcyjnej może modyfikować właściwości chemiczne sąsiednich grup alkilowych. I tak na przykład w alkenach stosunkowo łatwo jest wykonać reakcję podstawienia atomu wodoru przy atomie węgla sąsiadującym z atomem węgla wiązania podwójnego, nie naruszając przy tym podwójnego wiązania:
- CH2=CH—CH2—CH3 + Cl2 → CH2=CH—CHCl—CH3
Właściwość ta nie dotyczy jednak atomów wodoru położonych przy dalszych w łańcuchu atomach węgla. Nasuwa się tu następna uwaga natury ogólnej, że na pozór jałowe rozpatrywanie budowy elektronowej i przestrzennej związków organicznych jak i mechanizmów reakcji może mieć głębszy sens. Bowiem dzięki znajomości tych zagadnień możemy usystematyzować wiedzę chemiczną, aby nie była ona tylko katalogiem różnych reakcji, a po drugie możemy przewidywać przebieg innych, nieopisanych procesów.
- ↑ W starszych podręcznikach chemii organicznej (do końca XX w.) lokant umieszczano na początku nazwy, np. 2-buten, a w jeszcze starszych — na końcu nazwy, np. buten-2.
- ↑ Dla alkenów zawierających trzy oraz cztery różne podstawniki nazewnictwo "cis-trans" jest niewystarczające (niejednoznaczne). Stosuje się wtedy nomenklaturę Z-E, opartą na ustalaniu ważności podstawników przy każdym z osobna atomie węgla na podstawie masy atomowej podstawników. Z odpowiada izomerowi cis (od niemieckiego "zusammen" — razem), a E — izomerowi trans (od niemieckiego "entgegen" — naprzeciw).