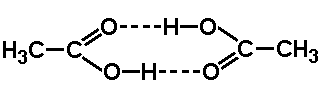Chemia organiczna/Kwasy karboksylowe
Do tej klasy zaliczamy związki zawierające grupę karboksylową, zapisywaną w skrócie jako COOH. W tej grupie karbonylowy atom węgla jest związany dodatkowo z grupą hydroksylową. Z uwagi na hybrydyzację typu [math]sp^2[/math] karbonylowego atomu węgla, podobnie jak w aldehydach i ketonach, wszystkie trzy związane z tym atomem podstawniki leżą w jednej płaszczyźnie.
Spis treści
Nazewnictwo kwasów karboksylowych.
Podobnie jak dla wielu klas związków organicznych, obok nazw systematycznych kwasów używa się nazw tradycyjnych. Nazwy systematyczne wywodzi się od nazw węglowodorów o takiej samej liczbie atomów węgla, poprzedzając nawę słowem "kwas" i dodając końcówkę -owy. I tak mamy po kolei kwasy: metanowy, etanowy, propanowy, butanowy itd. Gdy łańcuch węglowy zakończony jest z obu stron grupami karboksylowymi dajemy końcówkę kwas ...-diowy. Przykłady budowy i nazwy (systematyczne w nawiasie) kilkunastu kwasów podane są niżej na Rys. Figure 3.
Zwróćmy jeszcze uwagę na nazwę kwasu cykloheksanokarboksylowego. Nieraz, gdy węgiel grupy karboksylowej nie może być wliczony w łańcuch główny, stosujemy inny system nazewnictwa, mianowicie resztę węglowodorową określamy dodając do nazwy jej węglowodoru macierzystego łącznikowe -o-, a obecność grupy karboksylowej zaznaczamy końcówką -karboksylowy. I tak na przykład pokazany na Rys. Figure 3. kwas benzoesowy możemy nazwać kwasem benzenokarboksylowym. Inny przykład zastosowania tego systemu nazewnictwa podany jest niżej na Rys. Figure 4.:
Właściwości fizyczne kwasów karboksylowych i ich kwasowość.
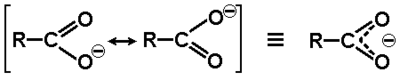
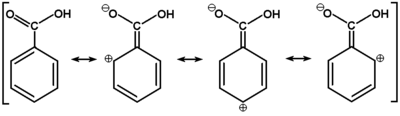
Związki zawierające grupę karboksylową wykazują wyraźnie zaznaczone właściwości kwasowe czyli zdolność do oddysocjowania protonu z grupy karboksylowej. Fakt ten tłumaczy się polaryzacją wiązania O—H wzmocnioną dodatkowo (w porównaniu np. z alkoholami) ściąganiem elektronów przez grupę karbonylową. Zasadnicze jednak działanie przypisuje się efektowi mezomerycznemu, który stabilizuje układ po oderwaniu protonu w anionie karboksylanowym. W anionie karboksylanowym atomy tlenu stają się równocenne i tworzy się wiązanie zdelokalizowane obejmujące swym zasięgiem oba atomy tlenu i węgiel karboksylanowy, tak jak to pokazane jest niżej na Rys. Figure 7.:
Stałą równowagi dysocjacji kwasów karboksylowych w roztworach wodnych definiuje się następująco, zgodnie z równaniem ogólnym podanym w rozdziale o fenolach:
- RCOOH + H2O → RCOO- + H3O+
- [math]K_a =\frac{ [\mathrm H_3\mathrm O^+][\mathrm{RCOO}^-]}{[\mathrm{RCOOH}]}[/math]
a [math]pK_a = \log K_a. [/math]
Stałe kwasowości zależą od budowy reszty węglowodorowej w kwasach karboksylowych. Wybrane przykłady są podane w poniższej Tabeli 15.1.:
| L.p. | Wzór | [math]K_a \times 10^5[/math] | L.p. | Wzór | [math]K_a \times 10^5[/math] |
|---|---|---|---|---|---|
| 1 | HCOOH | 17,7 | 8 | CH3CHClCH2COOH | 8,9 |
| 2 | CH3COOH | 1,75 | 9 | ClCH2CH2CH2COOH | 2,96 |
| 3 | ClCH2COOH | 136 | 10 | FCH2COOH | 260 |
| 4 | Cl2CHCOOH | 5530 | 11 | BrCH2COOH | 125 |
| 5 | CCl3COOH | 23200 | 12 | ICH2COOH | 67 |
| 6 | CH3CH2CH2COOH | 1,52 | 13 | C6H5CH2COOH | 4,9 |
| 7 | CH3CH2CHClCOOH | 139 | 14 | p-NO2C6H4CH2COOH | 14,1 |
Pokazane w Tabeli Figure 5. różnice w kwasowości grup karboksylowych położonych w różnym otoczeniu chemicznym najprościej tłumaczy się w oparciu o działanie efektu indukcyjnego. I tak, skoro grupa alkilowa spycha elektrony (por. z rozdziałem o reakcjach addycji elektrofilowej w alkenach i rozdziałem o sybstytucji elektrofilowej w alkilowych pochodnych benzenu), to zwiększa gęstość elektronową wiązania O—H utrudniając tym samym oddysocjowanie protonu, a zatem kwas etanowy (pozycja 2 w Tabeli Figure 5.) i jego dalsze homologi są kwasami słabszymi od kwasu metanowego (pozycja 1 w Tabeli Figure 5.). Przeciwny efekt indukcyjny wywołują fluorowce (ściągają elektrony), a więc kwasy fluorowcoetanowe (pozycje 3, 10-12 w Tabeli Figure 5.) są silniejsze od kwasu etanowego, przy czym wzrost kwasowości jest proporcjonalny do elektroujemności wprowadzonego pierwiastka. Najmocniejszy ujemny efekt indukcyjny wywołuje fluor w kwasie fluorooctowym, słabszy — chlor w kwasie chlorooctowym, jeszcze słabszy — brom w kwasie bromooctowym, a najsłabszy — jod w kwasie jodooctowym. Pierwiastki te ściągają elektrony tzn. zwiększają polaryzację wiązania O—H osłabiając je i ułatwiając oderwanie wodoru w postaci protonu. Wprowadzanie dalszych atomów chlorowca, tak jak to widać na przykładzie kwasów di- i trichlorooctowego (pozycje 4 i 5 w Tabeli Figure 5.) potęguje ten ujemny efekt indukcyjny i kwasy te stają się kwasami mocniejszymi od kwasu chlorooctowego (pozycja 3 w Tabeli Figure 5.). Na przykładzie różnie podstawionych chlorem kwasów butanowych (pozycje 6-9 w Tabeli Figure 5.) można prześledzić osłabianie efektu indukcyjnego wraz ze zwiększającą się odległością atomu chloru od wiązania O—H. Kwas fenylooctowy (pozycja 13 w Tabeli Figure 5.) jest nieco mocniejszy od kwasu etanowego, co wskazuje na pewien ujemny efekt indukcyjny pierścienia fenylowego (benzenowego). Gdy w pierścieniu aromatycznym obecny jest dodatkowy podstawnik ściągający elektrony (np. grupa nitrowa, pozycja 14 w Tabeli Figure 5.), to kwasowość wzrasta jeszcze bardziej.
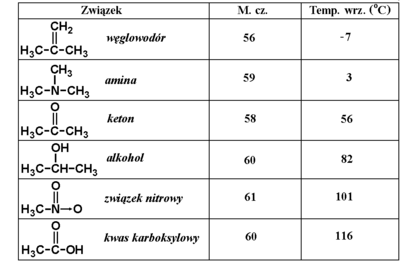
Cząsteczki kwasów karboksylowych odznaczają się dużą polarnością z powodu obecności silnie polarnej grupy karboksylowej. Ponadto atom wodoru grupy karboksylowej łatwo tworzy wiązania wodorowe. Te cechy fizykochemiczne powodują, że kwasy karboksylowe wykazują dość wysokie temperatury wrzenia. Krótkie zestawienie temperatur wrzenia związków z różnymi grupami funkcyjnymi podaje niżej Tabela Figure 6.:
Cząsteczki kwasów karboksylowych, dzięki wiązaniom wodorowym, mogą tworzyć układy dimeryczne:
Otrzymywanie kwasów karboksylowych.
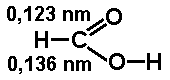
Kwasy karboksylowe znane są od dawna. Mogą być otrzymywane z produktów naturalnych oraz syntetycznie. Przykładami kwasów używanych na codzień jest ocet, czyli wodny roztwór kwasu octowego oraz kwasek cytrynowy (kwas cytrynowy). Wśród artykułów spożywczych mamy również do czynienia z kwasem mlekowym (2-hydroksypropanowym, patrz. Rys Figure 1.) występującym w kiszonych ogórkach, kapuście kiszonej i kwaśnym mleku. Niektóre kwasy karboksylowe występują obficie w przyrodzie, albowiem stanowią produkty przemian metabolicznych.
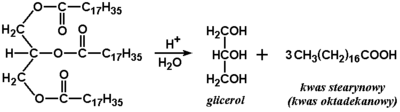
Do ogólnych chemicznych metod otrzymywania kwasów karboksylowych należy utlenianie alkoholi pierwszorzędowych lub aldehydów. Z reakcjami takimi zapoznaliśmy się już w poprzednich rozdziałach (przykładowe reakcje alkoholi oraz reakcje utleniania aldehydów). Kwasy otrzymuje się też w wyniku hydrolizy odpowiednich tzw. pochodnych kwasowych. Poniżej na Rys. Figure 8. pokazana jest reakcja hydrolizy tłuszczu, w wyniku której powstają kwasy o długich łańcuchach węglowych (zwane kwasami tłuszczowymi). Budowa tłuszczów zostanie omówiona w następnym rozdziale. Również w następnym rozdziale poznamy reakcje hydrolizy innych pochodnych kwasowych.
Kwasy aromatyczne z grupą karboksylową związaną bezpośrednio z pierścieniem aromatycznym otrzymuje się w wyniku utleniania łańcucha bocznego w odpowiednich węglowodorach lub ich pochodnych. Przykłady podane są poniżej na Rys. Figure 9.2.:
Reakcje kwasów karboksylowych.
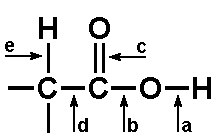
W zależności od tego, które wiązanie w cząsteczce kwasu jest rozrywane powstają różne produkty. Poniżej na Rys. Figure 10. strzałkami zaznaczone są miejsca reaktywne w układzie zawierającym grupę karboksylową:
Sole kwasów karboksylowych
Jeżeli kwas karboksylowy umieścimy w środowisku o wyższym pH niż charakterystyczny dla niego pKa, to nastąpi jego zobojętnienie, czyli oderwanie atomu wodoru z grupy O—H w postaci protonu i powstanie jon karboksylanowy (por. Rys. Figure 4., strzałka a) W takiej reakcji kwas karboksylowy zachowuje się jak kwas, to znaczy tworzy sole, np.:
- RCOOH + NaOH —→ RCOO-Na+ + H2O
Zgodnie z regułami chemii ogólnej kwasy karboksylowe mogą reagować również z niektórymi aktywnymi metalami tworząc też sole, np.:
- 2CH3COOH + Zn —→ (CH3COO)2Zn + H2(↑)
Sole kwasów karboksylowych znajdują spore zastosowanie w chemii gospodarczej, w kosmetykach, w farmaceutykach, jako dodatki w niektórych artykułach spożywczych i oczywiście jako reagenty w chemicznych procesach przemysłowych i laboratoryjnych. Jako przykład wykorzystania tych soli w życiu codziennym niech posłuży mydło, którego podstawowymi składnikami są sole sodowe lub potasowe kwasów tłuszczowych. Mydła otrzymuje się w wyniku hydrolizy tłuszczów (por. Rys. Figure 8.), ale wykonywanej w środowisku zasadowym. W takich warunkach tworzą się od razu sole kwasów karboksylowych. Sole sodowe kwasów tłuszczowych są substancjami o konsystencji stałej, używane są przeto do produkcji mydła twardego. Sole potasowe nadają się bardziej do uzyskiwania mydeł płynnych. Mydła dzięki swoistej budowie cząsteczkowej, w której występuje hydrofobowy fragment węglowodorowy o długim łańcuchu oraz bardzo polarna grupa karboksylanowa mają charakter środków powierzchniowo czynnych (detergentów). Sole sodowe i potasowe są rozpuszczalne w wodzie, natomiast w obecności jonów metali dwuwartościowych tworzą się z mydła sole nierozpuszczalne w wodzie. Duża zawartość jonów wapniowych i magnezowych w wodzie powoduje więc wytrącanie się osadu, zmniejszając znacznie wartości pieniące mydła. W takich przypadkach wodę charakteryzuje się jako twardą.
Figure 11: Przykładowa reakcja tworzenia się nierozpuszczalnego w wodzie stearynianu magnezu podczas używania mydła w twardej wodzie.
Reakcje substytucji nukleofilowej w grupie karboksylowej
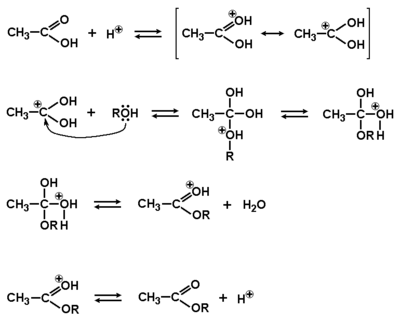
Jedną z ważniejszych reakcji kwasów karboksylowych jest podstawienie grupy OH przez inną grupę (Rys. Figure 4., strzałka b), przebiegające według mechanizmu substytucji nukleofilowej przy atomie węgla grupy karboksylowej. W zależności od odczynnika nukleofilowego atakującego węgiel grupy karboksylowej, po odejściu grupy OH powstają nowe wiązania: O=C—X (halogen), O=C—OR, O=C—O—C=O lub O=C—N. W tym podrozdziale zajmiemy się tylko podstawieniem grupy OR zamiast OH. Przykłady reakcji podstawienia innymi grupami będą pokazane w następnym rozdziale. Na Rys. Figure 12. pokazany jest mechanizm reakcji kwasu z alkoholem (tworzenia wiązania O=C—OR), czyli reakcji estryfikacji. Należy pamiętać, że wszystkie etapy reakcji estryfikacji są odwracalne, a więc w zależności od celu i warunków reakcji produktem może być ester, albo kwas karboksylowy (por. Rys. Figure 8.). Alkohol w reakcji estryfikacji jest czynnikiem nukleofilowym (dokładnie wolne pary elektronowe na atomie tlenu w alkoholu). Alkohol jest słabym odczynnikiem nukleofilowym, przeto w celu przyśpieszenia reakcji stosuje się dodatek mocnego kwasu nieorganicznego jako katalizatora. Protony kwasu nieorganicznego wzmacniają ładunek dodatni węgla karboksylowego i ułatwiają atak odczynnika nukleofilowego.
Kluczowy etap reakcji estryfikacji przedstawiony jest w drugiej linii schematu. Pokazany pośredni karbokation o budowie tetraedrycznej jest nietrwały i dąży do odtworzenia układu trygonalnego (odtworzenia wiązania [math]\pi[/math] grupy karbonylowej). Jeżeli eliminacji ulegnie cząsteczka alkoholu, to następuje odwrócenie procesu, a jeżeli cząsteczka wody, to tworzy się ester. W większości przypadków równowaga reakcji przesunięta jest na korzyść tworzenia się estrów, czyli eliminacji łatwiej ulega cząsteczka wody. Końcowy efekt reakcji zależy od budowy kwasu i alkoholu oraz wzajemnych stosunków stężeń substratów i produktów.
Redukcja kwasów karboksylowych
Kwasy karboksylowe można zredukować do alkoholi pierwszorzędowych za pomocą specjalnych reagentów, jakimi są glinowodorki, np. LiAlH4, lub borowodór (B2H6). Kwasy natomiast nie poddają się katalitycznej redukcji wodorem. Bezpośrednia reakcja redukcji kwasów podanymi odczynnikami jest znana w chemii organicznej dopiero od ok. 60 lat, czyli od chwili dostępności tych reagentów. Do połowy XX wieku redukcje grupy karboksylowej udawało się wykonać tylko metodami pośrednimi (wieloetapowymi).
| 1. LiAlH4 , eter | ||
| (CH3)3C—COOH | ——————→ | (CH3)3C—CH2OH |
| 2. H2O |
Mechanizm reakcji redukcji kwasu jest złożony. W uproszczeniu, pierwszy etap reakcji obejmuje atak jonu wodorkowego, jako odczynnika nukleofilowego, na węgiel grupy karboksylowej. Potem następuje eliminacja cząsteczki wody z utworzeniem aldehydu i następny atak jonu wodorkowego na węgiel grupy karbonylowej. W niektórych przypadkach można reakcję zatrzymać na etapie aldehydu. W nawiązaniu do Rys. Figure 4. reakcje redukcji obejmują więc rozerwanie wiązania C—O w grupie karboksylowej: najpierw wiązania [math]\pi[/math] (c na Rys. Figure 4.), a następnie wiązania [math]\sigma[/math] (c bądź b).
Reakcje dekarboksylacji
Reakcje dekarboksylacji przebiegają z rozerwaniem wiązania C—COOH (strzałka d na Rys. Figure 4.) i jednoczesną eliminacją dwutlenku węgla. Zwykłe kwasy ulegają takiej reakcji bardzo trudno. Wszelkie podstawniki o charakterze elektroujemnym w reszcie węglowodorowej kwasu zwiększają podatność na reakcję dekarboksylacji. Najczęściej właściwym substratem reakcji dekarboksylacji jest sól kwasu. Przykładem zastosowania laboratoryjnego reakcji dekarboksylacji jest otrzymywanie metanu w wyniku reakcji termicznego rozkładu octanu sodu:
| CaO, 300°C | ||
| CH3COONa + NaOH | ————→ | CH4 + Na2CO3 |
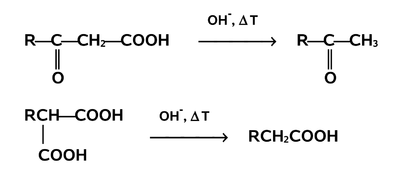
Znaczenie w syntezie organicznej mają reakcje dekarboksylacji pochodnych [math]\beta[/math]-ketokwasów (kwasów 3-oksoalkanowych) i kwasu malonowego. Przykłady takich reakcji pokazane są niżej na Rys. Figure 15.
Reakcje dekarboksylacji odgrywają dużą rolę w procesach metabolicznych w żywych komórkach, zachodzących z udziałem odpowiednich enzymów.
Reakcje substytucji przy węglu [math]\alpha[/math] w kwasach karboksylowych
Rozerwanie wiązania C—H przy atomie węgla sąsiednim do grupy karboksylowej (strzałka e na Rys. Figure 4.) możliwe jest pod działaniem bromu lub chloru w obecności fosforu jako katalizatora. Tak otrzymane 2-bromo- lub 2-chlorokwasy są następnie wykorzystywane do syntezy innych pochodnych np. 2-hydroksy- lub 2-aminokwasów.
| P | ||
| R—CH2—COOH + Br2 | ——→ | R—CHBr—COOH + HBr |
Substytucja elektrofilowa w kwasie benzoesowym
Grupa karboksylowa, podobnie jak grupa karbonylowa w aldehydach i ketonach aromatycznych dezaktywuje pierścień i kieruje podstawniki elektrofilowe w położenie meta. Jak widać na Rys. Figure 17., w strukturze kwasu benzoesowego wskutek sprzężenia elektronów [math]\pi[/math] grupy karboksylowej z elektronami pierścienia następuje zubożenie gęstości elektronowej pierścienia, najmocniej zaznaczone w pozycjach orto i para, a więc odczynniki elektrofilowe atakują raczej pozycje meta.
Grupy acylowe.
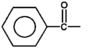
Z uwagi na częste występowanie grup karbonylowych, różnie związanych w strukturach związków, w celach nomenklaturowych wprowadzono specjalne nazwy dla reszt zawierających grupy karbonylowe. Ogólnie takie podstawniki nazywamy resztami lub grupami acylowymi. Kilka przykładów nazw grup acylowych przedstawiono poniżej w Tabeli 15.3.