Chromatografia elektroforeza
Spis treści
Zadanie 1
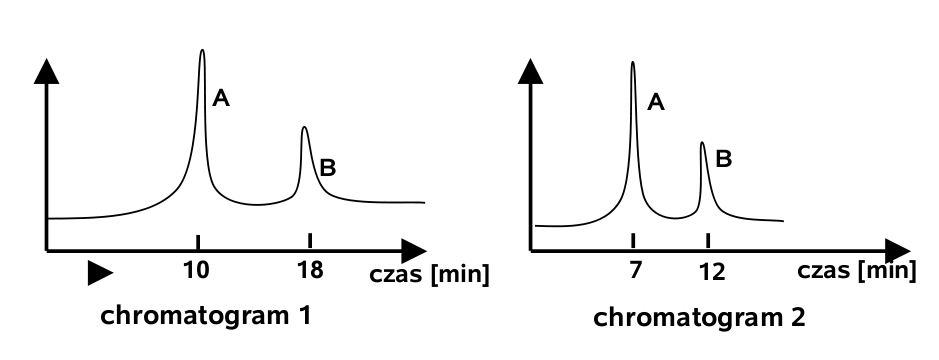
Chromatogram 1 uzyskano metodą chromatografii HPLC (highperformance liquid chromatography) dla próbki będącej mieszaniną dwóch cukrów A i B. Chromatogram 2 uzyskano dla tej samej mieszaniny, ale zastosowano inne warunki HPLC.
Rozważ następujące zmiany warunków, w których uzyskano chromatogram 2:
- zmniejszenie ciśnienia fazy mobilnej,
- zmniejszenie temperatury,
- zastosowanie kolumny o mniejszym stopniu upakowania,
Która z powyższych zmian odpowiada za różnice widoczne między chromatogramami 1 i 2? Odpowiedź uzasadnij.
Zadanie 2
Karbamoilotransferaza asparaginianowa (ATC-aza) to enzym biorący udział w syntezie zasad azotowych z grupy pirymidyn. Posiada niezwykłą budowę podjednostkową, która można określić stosując filtrację żelową (chromatografia typu sita molekularnego) i elektroforezę denaturującą (SDS-PAGE; SDS polyacrylamide gel electrophoresis). Hipotetyczne wyniki zostały zebrane poniżej.
Tabela Figure 1 zawiera listę białek użytych do kalibracji kolumny chromatograficznej, ich masy cząsteczkowe oraz objętości, przy których zostały wymyte z kolumny.
- Objętość elucji karbamoilotransferazy asparaginianowej na tej kolumnie wynosi 101 ml. Ile wynosi jej masa cząsteczkowa?
Białko Masa cząsteczkowa M [g] Objętość elucji V [ml] Cytochrom c 12 400 208 Mioglobina 17 800 194 Chymotrypsynogen 25 000 185 BSA 66 200 152 Dehydrogenaza mleczanowa 295 000 102 Apoferrytyna 475 000 90 - Enzym został poddany działaniu czynnika redukującego mostki disiarczkowe i ponownie przepuszczony przez kolumnę. Tym razem pojawiły się dwa piki, przy objętości 138 i 174 ml. Jakim masom odpowiadają?
- Następnie przeprowadzono elektroforezę denaturującą enzymu na żelu poliakrylamidowym. Białka przedstawione w tabeli Figure 2 zostały użyte do kalibracji żelu. Na żelu zaobserwowano dwa prążki pochodzące od karbamoilotransferazy w odległości 58 i 82 mm od początku żelu separującego. Jakie masy im odpowiadają?
Białko Masa cząsteczkowa M [g] Odległość d [mm] Lizozym 14 400 88 β-laktoglobulina 18 400 78,2 Anhydraza węglanowa 29 000 70,0 Dehydrogenaza mleczanowa 35 000 55,2 Ovalbumina 45 000 46,0 BSA 66 200 30,2 β-galaktozydaza 116 000 10,0 - Jakie wnioski dotyczące budowy czwartorzędowej karbamoilotransferazy aspartanowej możesz wysnuć na podstawie wyników uzyskanych w pktach a.-c.?
Zadanie 3
Punkt izoelektryczny pewnego białka jest równy wartości pH , w którym przeprowadzana jest elektroforeza natywna. Do której elektrody (do katody czy anody) będzie migrowało to białko?
Zadanie 4
Jak zwiększenie stężenia akrylamidu wpływa na rozmiary porów żelu i rozdział makrocząsteczek pod względem wielkości?
Zadanie 5
Jakiego typu nośnika używa się w przypadku elektroforezy makrocząsteczek o masach większych niż [math]\unit{100\times10^3}{ kDa}[/math] (np. dwuniciowego DNA), które są zbyt duże by penetrować pory żelu poliakrylamidowego?
Zadanie 6
Który z poniższych czynników: pH, siła jonowa, temperatura czy natężenie prądu, mają największy wpływ na rozdział białek w przypadku elektroforezy natywnej? Odpowiedź uzasadnij.