Metody Biofizyki Molekularnej/Kalorymetria
Spis treści
- 1 Wstęp
- 2 Podstawowe pojęcia termodynamiczne
- 3 Podstawowe wiadomości o równowagach
- 4 Historia
- 5 Dwa typy eksperymentów kalorymetrycznych
- 5.1 Kalorymetr ITC
- 5.1.1 VP-ITC
- 5.1.2 ITC — Techniki inicjalizacji reakcji
- 5.1.3 Etapy eksperymentu ITC
- 5.1.4 Plan eksperymentu na podstawie wykonanych symulacji
- 5.1.5 Parametr sigmoidalności
- 5.1.6 Co zrobić jeśli nie można wyznaczyć bezpośrednio parametrów termodynamicznych?
- 5.1.7 Zebranie danych pomiarowych
- 5.1.8 Przepływ protonów
- 5.1.9 Analiza danych kalorymetrycznych
- 5.1.10 Przykłady
- 5.2 ITC — enzymatyczne eksperymenty kinetyczne
- 5.3 DSC — różnicowa kalorymetria skaningowa (Differential Scanning Calorimetry)
- 5.1 Kalorymetr ITC
Wstęp
Termodynamika — matematyczny opis ciepła i jego związku z energia mechaniczną i pracą. Umożliwia przewidywanie czy reakcja chemiczna (biochemiczna) będzie zachodziła, w jakim kierunku i kiedy osiągnie stan równowagi.Rozważa zależności między układem a otoczeniem.
- Termodynamika szuka odpowiedzi na pytania:
- Jaka równowaga została osiągnięta ?
- Jak system doszedł do równowagi?
- Jak system zachowa się w odpowiedzi na jego zaburzenie?
- Metody badania :
- wprowadzenie zaburzenia układu,
- obserwacja zmian,
- dopasowanie modelu.
- Czynniki zaburzające układ:
- denaturanty,
- ciepło,
- sól,
- rozpuszczalniki,
- ligandy .
- Termodynamiczne metody pomiaru:
- kalorymetria:
- DSC : kalorymetria skaningowa (Differential Scanning Callorimetry).
- ITC : kalorymetria miareczkująca (Isothermal Titration Callorimetry).
- Osmometria.
- kalorymetria:
Podstawowe pojęcia termodynamiczne
Stan termodynamiczny to wartość wszystkich funkcji stanu (np. ciśnienie, objętość, temperatura, masa, entropia, energia wewnętrzna) układu termodynamicznego w określonej chwili. Przejście z jednego stanu termodynamicznego do drugiego nazywane jest przemianą termodynamiczną.
Klasyfikacja podstawowych przemian termodynamicznych
- przemiana izobaryczna (stałe ciśnienie [math]p = \mathrm{const}\;[/math]),
- przemiana izotermiczna (stała temperatura [math]T = \mathrm{const}\;[/math]),
- przemiana izochoryczna (stała objętość [math]V = \mathrm{const}\;[/math]),
- przemiana adiabatyczna (brak wymiany ciepła z otoczeniem [math]Q = \mathrm{const}\;[/math]).
W zależności od relacji pomiędzy układem i otoczeniem możemy mówić o układach:
- otwartych — wymieniających z otoczeniem energię i materię,
- zamkniętych — wymieniających tylko energię, materia pozostaje stała,
- izolowanych — nie wymieniają z otoczeniem energii i materii,
- izotermicznych — układy pozostające w stałej temperaturze,
- adiabatycznych — izolowanych termicznie od otoczenia (energia może być wymieniana jako praca, a nie jako ciepło).
Zerowa zasada termodynamiki = prawo równocenności stanów układów termodynamicznych:
Jeśli układy A i B mogące ze sobą wymieniać ciepło są ze sobą w równowadze termicznej, i to samo jest prawdą dla układów B i C, to układy A i C również są ze sobą w równowadze termicznej.
Sposoby przekazywania energii:
- ciepło — transfer energii w wyniku bezładnego ruchu, wynikający z różnicy temperatur układu i otoczenia,
- praca — transfer energii w wyniku ruchu uporządkowanego (wydatek energii przeciwko działającej sile):
- [math]\Delta W = F\cdot \Delta S\;[/math]
- [math]\Delta W_\mathrm{obj}=p\cdot\Delta V\;[/math].
- [math]\Delta W = F\cdot \Delta S\;[/math]
- Całkowita ilość energii w układzie to energia wewnętrzna, możemy mierzyć tylko jej zmiany [math]\Delta U\;[/math].
Wielkości termodynamiczne możemy podzielić na:.
- funkcje stanu — wartość zależy od stanu układu w danym momencie, np. objętość, ciśnienie, energia wewnętrzna, entropia,
- funkcje zależne od drogi — wartość zależy od drogi , na której układ zmienia się od jednego stanu do drugiego (praca, ciepło).
Pierwsza zasada termodynamiki: Całkowita energia układu izolowanego jest stała.
Układ może zmieniać swój stan energetyczny na drodze wykonania pracy lub oddania/pobrania ciepła. Praca i ciepło są funkcjami zależnymi od drogi. Przy zmianie energii wewnętrznej układu ilość utraconej na skutek wykonania pracy lub poboru ciepła zależy od tego jak wydajnie wydobywana jest energia (samochód).
Praca objętościowa [math]p\Delta V\;[/math] (najczęściej spotykana).
Gdy wydziela się gaz w reakcji pod stałym ciśnieniem praca polega na rozszerzaniu otoczenia (balon):
- [math] W=-p_\mathrm{zewn}\Delta V\;[/math]
Zmiana energii wewnętrznej: [math]\Delta U=- p_\mathrm{zewn}\Delta V +q\;[/math].
Pojemność cieplna — jeśli do układu dostarczamy energię w postaci ciepła to wzrost temperatury jest proporcjonalny do ilości dostarczonego ciepła, a współczynnikiem proporcjonalności jest pojemność cieplna.
- [math]\mathrm dq=C\mathrm dT\;[/math]
- Pojemność cieplna w stałej objętości [math]C_v\;[/math].
- Pojemność cieplna przy stałym ciśnieniu [math]C_p\;[/math].
- [math]C_p=C_v+nR \;[/math]
Dla stałej objętości ciepło dostarczone jest równe zmianie energii wewn.: [math]\Delta U=C_v \Delta T\;[/math].
Molowa pojemność cieplna [math]C_m=\nicefrac Cn[/math], im większa tym więcej ciepła potrzeba do osiągnięcia wzrostu temperatury.
Entalpia
Reakcje biochemiczne zachodzą w warunkach stałego ciśnienia przy małych zmianach objętości. Gdy ciśnienie jest stale, a wykonywana pracą jest jedynie praca objętościowa mamy:
- [math]\Delta U=q-p_\mathrm{zewn}\Delta V\;\;[/math]
Entalpię [math]H\;[/math] definiujemy jako [math]H=U+pV\;\;[/math] Dla zmiany skończonej pod stałym ciśnieniem mamy
- [math]\Delta H=\Delta U+p_\mathrm{zewn}\Delta V\;\;[/math]
Jeśli jedyną wykonaną pracą jest praca objętościowa to zmiana entalpii w procesie równa jest ciepłu wymienionemu w układzie pod stałym ciśnieniem:
- [math]\Delta H=q\;\;[/math].
W przypadku reakcji gazu doskonałego, w której wydziela się lub zużywa ciepło zmiana entalpii wynosi:
- [math]\Delta H=\Delta U+\Delta nRT\;\;[/math]
gdzie [math]\Delta n\;[/math] — zmiana liczby moli cząsteczek składnika gazowego, [math]R\;[/math] — stała gazowa, [math]T\;[/math] — temperatura.
Właściwości entalpii
- Funkcja stanu,
- Nie można podać bezwzględnej wartości entalpii, można mierzyć jej zmiany \Delta H związane z utratą lub dostarczeniem ciepła.
- Proces endotermiczny — [math] \Delta H \gt 0\;[/math], wzrost temperatury
- Proces egzotermiczny — [math]\Delta H \lt 0\;[/math], spadek temperatury
- Zmiana entalpii wynikająca ze zmiany temperatury przy stałym ciśnieniu:
- [math]\Delta H = \int_{T_1}^{T_2} C_p(T)\mathrm dT\;\;[/math]
- W reakcji chemicznej zmiana entalpii równa jest różnicy entalpii produktów i substratów: (bo funkcja stanu)
- [math]\Delta H=\sum H_\mathrm{produkty}-\sum H_\mathrm{substraty}\;\;[/math]
- Prawo Kirchhoffa: ponieważ entalpia każdego ze składników zmienia się wraz z temperaturą [math]\Delta H\;\;[/math] zależy również od temperatury:
- [math]\Delta H_{T_2} =\Delta H_{T_1} + \int_{T_1}^{T_2} \Delta C_p(T)\mathrm dT \;\;[/math]
- Gdy zmianę [math]C_p\;[/math] wraz z temperaturą można zaniedbać:
- [math]\Delta H_{T_2} =\Delta H_{T_1} +\Delta C_p\Delta T\;\;[/math]
Zmiany entalpii zależą od temperatury, ciśnienia, ilości i stanu skupienia substratów i produktów.
Prawo Hessa
Całkowita zmiana entalpii w reakcji jest równa sumie zmian entalpii w oddzielnych etapach reakcji, mierzonych w tej samej temperaturze.
Często spotykane zmiany entalpii: jonizacji, przyłączenia, parowania, sublimacji, reakcji, spalania, tworzenia, rozpuszczania…
Entropia
Proces odwracalny — kierunek przepływu energii może zostać zmieniony w każdym momencie przez zmianę warunków. W czasie trwania procesu układ jest w równowadze, wymiana energii następuje nieskończenie powoli.
Proces nieodwracalny — kierunek przepływu energii nie może zostać zmieniony. W praktyce cześć energii jest rozpraszana jako ciepło, którego nie można odzyskać i w celu odtworzenia warunków wyjściowych należy wykonać pracę. Zmiana entropii procesu w warunkach izotermicznych określona jest następująco:
- [math]\mathrm dS = \frac{\mathrm dq_\mathrm{odwr}}T\;[/math] — proces odwracalny,
- [math] \mathrm dS \gt \frac{\mathrm dq}T\;[/math] — proces nieodwracalny
(funkcja stanu)
Druga zasada termodynamiki:
Całkowita zmiana entropii wynosi zero w przypadku procesu odwracalnego i jest większa od zera w przypadku procesu nieodwracalnego.
Pomiar pojemności cieplnej [math]C\;[/math] w funkcji temperatury umożliwia wyznaczenie entropii Jeśli do układu dopływa ciepło w sposób odwracalny to: [math] \mathrm dq_\mathrm{odwr}=C\mathrm dT\;[/math] oraz [math]\mathrm dS=\frac{C\mathrm dT}T\;[/math], a zmiana entropii:
- [math]\Delta S = \int_{T_1}^{T_2} \frac CT\mathrm dT\;[/math].
W przypadku przemiany fazowej zachodzącej pod stałym ciśnieniem [math]q_\mathrm{odwr} =\Delta H_\mathrm{p.f.}\;[/math].
W procesie parowania [math]\Delta S =\frac{\Delta H_\mathrm{par}}T\;[/math].
[math]\Delta S_\mathrm{par} =\unit{ 85}{\frac JK}\;[/math] dla większości cieczy (wyjątek woda, amoniak wykazują pewny stopień uporządkowania w stanie ciekłym i [math]\Delta S\;[/math] przy przejściu w stan gazowy jest większe).
Entropia jako miara nieuporządkowania układu (statystyczna definicja entropii) — równanie Boltzmanna:
- [math]S=k_B\ln W\;[/math],
gdzie: [math]W\;[/math] — liczba możliwych konfiguracji układu, [math]k_B\;[/math] — stała Boltzmanna.
Doskonale uporządkowany układ o najmniejszej entropii jest najmniej prawdopodobny.
Trzecia zasada termodynamiki:
Entropia doskonałego kryształu w temperaturze zera bezwzględnego wynosi zero (kryształ doskonały — jedno ułożenie składników, temperatura zera bezwzględnego — brak zmian dynamicznych) [math] W = 1\ S = k_B\ln W = 0\;[/math].
Zmiany entropii można wyznaczać na podstawie pomiarów pojemności cieplnych, entropia ma mierzalną wartość bezwzględną.
Procesy samorzutne — zachodzą bez konieczności wykonania pracy na układzie.
Procesy niesamorzutne — nie wykazują tendencji do zachodzenia. Aby zachodziły do układu należy dostarczyć energię na sposób pracy.
Entropia układów izolowanych wzrasta, jeżeli zachodzą w nich procesy nieodwracalne, lub pozostaje stała, jeżeli zachodzą procesy odwracalne (druga zasada termodynamiki).
Entropia układu izolowanego nigdy nie maleje:
- [math]\Delta S_c\geq 0\;[/math].
Idealnym układem izolowanym jest Wszechświat.
Układy doświadczalne nie są układami izolowanymi.
Całkowita zmiana entropii sumą zmian entropii układu i otoczenia.
- [math] \Delta S_\mathrm{calk} = \Delta S_\mathrm{uklad} + \Delta S_\mathrm{otoczenie}\;[/math]
- [math] \Delta S_\mathrm{otoczenie}=- \frac{\Delta H_\mathrm{uklad}}T\;[/math] (związek entropii z entalpią pod stałym ciśnieniem)
- [math] -T\Delta S_\mathrm{calk} = -T\Delta S_\mathrm{uklad} + \Delta H_\mathrm{uklad}\;[/math]
Standardowa entropia reakcji — różnica między standardowymi entropiami produktów i substratów:
- [math]\Delta S_\mathrm{proces} = \sum S_\mathrm{produkty}-\sum S_\mathrm{substraty}\;[/math].
Całkowita zmiana entropii sumą zmian entropii układu i otoczenia.
Entalpia swobodna (energia swobodna Gibbsa, funkcja Gibbsa)
- [math]G = H - TS \;[/math]
- [math]\Delta G= \Delta H_\mathrm{uklad} - T\Delta S_\mathrm{uklad}\;[/math]
[math]S_\mathrm{uklad}\;[/math] — zmiany skończone pod stałym ciśnieniem i w stałej temperaturze.
- [math]\Delta G= - T\Delta S_\mathrm{calk}\;[/math] — entalpia swobodna jest miarą całkowitej zmiany entropii.
- [math]\mathrm dG \lt 0\;[/math] dla procesu samorzutnego pod stałym ciśnieniem.
Energia swobodna
Inaczej energia Helmholtza, funkcja Helmholtza. Stosowana jest do opisu pracy w stałej objętości i temperaturze
- [math]A=U-TS\;[/math]
- [math]\Delta A=-T\Delta S_\mathrm{calk}\;[/math] w stałej objętości
- [math]\Delta A\lt 0 \;[/math] dla procesu samorzutnego w stałej objętości.
Pojęcie energii swobodnej jest użyteczne w układach zamkniętych, w których zmiany następują w stałej objętości (ciała stałe).
Większość układów biochemicznych działa pod stałym ciśnieniem — częściej stosuje się pojęcie entalpii swobodnej.
Entalpia swobodna i energia swobodna:
- Funkcje stanu.
- Niemierzalne wartości bezwzględne.
- Są wskaźnikiem samorzutności procesu.
- Reprezentują maksymalną pracę, którą można uzyskać z procesu ( poza pracą
zmiany objętości). Przewidywanie warunków, w których reakcja jest samorzutna:
| [math]\Delta H\;[/math] | [math]\Delta S\;[/math] | Samorzutna? | Samorzutności sprzyjają |
|---|---|---|---|
| Ujemne | Dodatnie | W każdych warunkach | Każde warunki |
| Ujemne | Ujemne | Jeśli [math]|T\Delta S |\lt |\Delta H|\;[/math] | Niskie temperatury |
| Dodatnie | Dodatnie | Jeśli [math]|T\Delta S |\gt |\Delta H|\;[/math] | Wysokie temperatury |
| Dodatnie | Ujemne | Nigdy | Nie sprzyjają żadne warunki |
Biokalorymetria — pomiary kalorymetryczne procesów biochemicznych.
- [math]H=U+pV\;[/math]
Entalpia
Entalpia zależy od temperatury, ciśnienia i stanu molekuł.
Standardowa entalpia reakcji (solwatacji, itp.): zmiana entalpii odpowiadająca zmianie entalpii w trakcie reakcji 1 mola cząsteczek w temp. 25°C, pod ciśnieniem 1 atm. [math]\Delta H\;[/math] jest miara zmian pojemności cieplnej [math]\Delta C_p\;[/math]. Gdy zmienia się kontakt powierzchni hydrofobowej z woda zmienia się też pojemność cieplna, określenie [math]\Delta C_p\;[/math] dostarcza informacji o zmianie stopnia ekspozycji powierzchni białka podczas reakcji.
Zmiany entalpii wynikają z reorganizacji oddziaływań międzycząsteczkowych, tworzenia nowych oddziaływań, zmianie hydratacji grup polarnych i niepolarnych.
Entropia
Idealny kryształ bez drgań [math]-S=0\;[/math].
Wzrost temperatury, przejście ciało stałe–ciecz–gaz — wzrost entropii. Absorpcja ciepła powoduje wzrost entropii.
Dla reakcji samorzutnej:
- [math]T\Delta S - \Delta H \gt 0\;[/math]
Czyli:
- [math]T\Delta S \gt \Delta H\;[/math]
Aby reakcja była samorzutna entropia musi być wystarczająco wysoka. Ma to miejsce w podwyższonej temperaturze.
Zmiana entropii jest sumą:
- zmian entropii hydratacji (uporządkowanie cząsteczek wody na powierzchni białka),
- zmian entropii konformacyjnej i entropii dynamiki wiązań,
- zmian entropii związanej z translacji i rotacji cząstek po utworzeniu kompleksu.
Energia swobodna — energia, którą można wykorzystać do wykonania pracy. Dla reakcji samorzutnych [math]G\;[/math] maleje, czyli:
- [math]\Delta G =T\Delta S - \Delta H \lt 0\;[/math]
Tylko część energii swobodnej może być zamieniona na pracę, reszta jest zaangażowana w zmiany entropii.
Podstawowe wiadomości o równowagach
Biologiczny stan standardowy stan czystej substancji pod ciśnieniem 1 atmosfery w określonej temperaturze (zwyczajowo 25°C). Dla roztworów substancja rozpuszczona ma stężenie 1 M, a stężenie jonów wodorowych odpowiada pH 7,0. Jest to stan względem którego mierzone są wszelkie zmiany i z nim porównywane.
- [math]A_+A_2+A_3+\ldots \overset{k_1}\underset{k_2}\Longleftrightarrow B_1+B_2+B_3+\ldots\;[/math]
Rozważmy:
- [math]K = \frac{[B_1][B_2][B_3]\cdot \ldots}{[A_1][A_2][A_3]\cdot \ldots}\;[/math]
- [math]\Delta G = -RT\ln K\;[/math]
W warunkach standardowych [math]K=1\;\;[/math]
- [math]\Delta G^\theta = -RT\ln K_\mathrm{eq}\;[/math]
Dla [math]K\gt 1\ \Delta G\lt 0\;[/math] — reakcja samorzutna.
Dla [math]K\lt 1\ \Delta G\gt 0\;[/math] — reakcja niesamorzutna.
Z równania:
- [math]\Delta G^\theta =\Delta H^\theta-T\Delta S^\theta = -RT \ln K_\mathrm{eq} \;[/math]
można wyznaczyć [math]\Delta S\theta\;[/math] w dowolnej temperaturze [math]T\;[/math], jeśli znamy wartość [math]\Delta H^\theta[/math]. Po przekształceniu: [math]\ln K_\mathrm{eq} = - \frac{\Delta G\theta}{RT} = \frac{\Delta S\theta}R - \frac{\Delta H\theta}{RT}\;[/math]. Dla bardzo małych zmian temperatury, [math]dT\;[/math], można przyjąć, że [math]\Delta H^\theta\;[/math] i [math]\Delta S^\theta\;[/math] są niezależne od [math]T\;[/math]. Dlatego pod stałym ciśnieniem:
- [math]\frac{\mathrm d\ln K_\mathrm{eq}}{\mathrm d T}= \frac{\Delta H^\theta}{RT^2}\;[/math] (równanie van’t Hoffa).
Stad możemy wyznaczać [math]\Delta H^\theta\;[/math] w dowolnej temperaturze [math]T\;[/math]. Jeśli [math]K_\mathrm{eq}=1\;[/math] to [math]\Delta G^\theta=0\;[/math]. Rozważmy prostszy układ:
- [math]A+B \underset{k_\mathrm{off}}\overset{k_\mathrm{on}}\Longleftrightarrow A\cdot B\;[/math].
Stała dysocjacji jest definiowana następująco:
- [math]K_d = \frac{[A][B]}{[AB]}\;[/math].
Szybkość reakcji w kierunku syntezy produktu:
- [math]k_\mathrm{on}\cdot [A][B]\;[/math].
Szybkość reakcji w kierunku rozpadu produktu:
- [math]k_\mathrm{off}\cdot [AB]\;[/math].
W równowadze:
- [math]k_\mathrm{on}\cdot [A][B]=k_\mathrm{off}\cdot [AB]\;[/math].
Stąd:
- [math]\frac{k_\mathrm{off}}{k_\mathrm{on}}=\frac{[A][B]}{[AB]} = K_d\;[/math].
W stanie równowagi:
- [math]\Delta G = -RT\ln K_\mathrm{eq} = RT\ln K_d\;[/math].
Stała asocjacji jest odwrotnością stałej dysocjacji:
- [math]K_d = \frac 1{K_\mathrm{eq}}=\frac 1{K_\mathrm{as}}\;[/math].
Zerwanie wiązania wymaga mniej energii niż jego utworzenie — reakcja egzotermiczna. W przeciwnym przypadku — reakcja endotermiczna. W trakcie procesów niewymagających zerwania wiązań (folding) również następuje przepływ ciepła na skutek zmiany otoczenia fragmentów bialka.
Teoria kolizji
Reagenty aby utworzyć lub zniszczyć wiązanie muszą się zderzyć. Jeśli mają energię wyższą niż energia aktywacji zachodzi reakcja chemiczna. Liczbę cząsteczek o energii wyższej niż energia aktywacji opisuje rozkład Boltzmanna:
- [math]n = n_0 e^{-\nicefrac {E_a}{RT}}\;[/math]
[math]n_0\;[/math] — całkowita liczba cząsteczek.
Procesy w układach biologicznych są czułe na temperaturę i zachodzą tylko w jej wąskim zakresie zdeterminowanym przez :
- prawo Arrheniusa
- [math]k = A e^{-\nicefrac {E_a}{RT}}\;[/math].
- Denaturację w podwyższonej temperaturze.
Reakcje (rozrywanie lub powstawanie wiązań chemicznych) zachodzą tylko wtedy, gdy biomolekuły mają energię wyższą niż energia aktywacji i ulegają zderzeniom.
Odziaływania makromolekuł z punktu widzenia termodynamiki możemy podzielić na:
- sterowane entropowo, typowe dla oddziaływań antygen-przeciwciało i białko-DNA ,
- sterowane entalpowo, średnie i słabe oddziaływania,
- sterowane entropowo-entalpowo. oddziaływania bardzo silne i specyficzne (proteaza-inhibitor).
Historia
W 1760 roku Black skonstruował pierwszy kalorymetr i zmierzył pojemność cieplną wody. W latach 80 XVIII wieku Lavoisier zaprojektował kalorymetr lodowy i wykorzystał go do pomiarów ciepła przemian metabolicznych produkowanego przez świnkę morską. W 1840 roku Joule (piwowar i naukowiec–amator) udowadnił, ze ciepło można zamienić na pracę. W 1850 roku Clausius wprowadził pojęcie entropii oraz I i II zasadę termodynamiki. W II pol. XIX w. prace Maxwella i Gibbsa nadały termodynamice postać matematyczną. W 1918 roku Nernst sformułował III zasadę termodynamiki.
Współczesne pomiary DSC datują się od lat 60-tych XX wieku, a ITC od końca lat 80-tych XX wieku. Rozwojem tych techniki pomiarowej zajmował się Peter Privalov
Kalorymetria — opiera się na pomiarach ciepła pochłoniętego lub wyemitowanego z układu. Jest to pomiar bezpośredni zmian stanu układu za pomocą kalorymetru.
Kalorymetry umożliwiają:
- wyznaczanie ciepła właściwego cieczy i ciał stałych, ciepła topnienia i ciepła parowania,
- badanie zmian w czasie wartości termodynamicznych takich jak entalpia i entropia układu.
Rodzaje kalorymetrów:
- kalorymetr wodno-lodowy,
- bomba kalorymetryczna,
- kalorymetr przepływu ciepła,
- kalorymetr bilansu ciepła,
- kalorymetr różnicowy,
Metody wykonywania pomiarów kalorymetrycznych:
- Pomiary zmiany temperatury.
Ciepło pobierane lub oddawane w trakcie reakcji chemicznej powoduje zmianę temperatury w celce pomiarowej, która się rejestruje. Dzięki odpowiedniej kalibracji instrumentu można obliczyć ilość energii stowarzyszonej ze zmianą temperatury. - Metoda kompensacji mocy.
Celka jest utrzymywana w stałej temperaturze, dzięki zastosowaniu kontrolera, który chłodzi lub grzeje celkę w trakcie zachodzącej endo- lub egzotermicznej reakcji. Sygnałem pomiarowym jest moc (μcal/s, μJ/s) potrzebna do utrzymania celki w stałej temperaturze, takiej samej jak temperatura celki referencyjnej. - Pomiary przepływu cieplnego
Temperatura celki pomiarowej jest utrzymywana na stałym poziomie dzięki odprowadzaniu nadmiaru ciepła przez odpowiedni czujnik. Wielkością mierzoną jest niewielkie napięcie proporcjonalne do niewielkiej różnicy temperatur powstającej w trakcie zachodzenia reakcji.
Dwa typy eksperymentów kalorymetrycznych
ITC — izotermiczna kalorymetria miareczkująca (isothermal scanning callorimetry).
- Pomiary [math]\Delta H\;[/math] związanego z procesami takimi jak wiązanie ligandów, tworzenie kompleksów, pomiar równowagowych stałych asocjacji (Z eksperymentu ITC otrzymujemy informacje o stałej asocjacji [math](K_\mathrm{as}\;[/math]), zmianie entalpii asocjacji [math](H_\mathrm{as})\;[/math], stechiometrii wiązania. Otrzymane parametry zależą od warunków pomiaru!).
- Ograniczenie: niskie stężenia białek i związany z tym mała wartość emitowanego lub pochłanianego ciepła.
DSC — różnicowa kalorymetria skaningowa (differential scanning callorimetry).
- Zmiany fazowe w biopolimerach inicjowane dostarczeniem ciepła.
Kalorymetr ITC
VP-ITC
- Objętość celki ~1.4 ml.
- Objętość strzykawki ~ 270ml.
- Peltier 2-800 C.
- Szum 0.5 ncal/s.
ITC — Techniki inicjalizacji reakcji
- Mieszanie, poprzez obracanie całej celki, i roztworów osobno dodanych do celki pomiarowej lub rozerwaniu ampułki z jednym reagentem w roztworze drugiego reagenta lub wprowadzenie dużej objętości jednego reagenta do celki z drugim reagentem w celu zainicjowania reakcji (np. enzymatycznej).
- Miareczkowanie — kilkakrotne, stopniowe, ze stałym interwałem czasowym, wprowadzanie niewielkich ilości jednego reagenta do celki z drugim reagentem, aż do zakończenia procesu.
- Metoda przepływowa — pomiar ciepła wydzielanego w trakcie przepływu reagentów. Ze względu na wolną odpowiedz kalorymetru metoda ta nie jest stosowana.
Etapy eksperymentu ITC
- Plan eksperymentu na podstawie wykonanych symulacji.
- Przygotowanie roztworu ligandu i makromolekuł.
- Zebranie danych pomiarowych.
- Wykonanie pomiarów kontrolnych, tzw. ślepa próba (np. bufor-bufor).
- Nanoszenie poprawek związanych ze ślepą próbą.
- Analiza poprawionych danych, wyznaczenie parametrów termodynamicznych.
- Krytyczna interpretacja wyników.
Plan eksperymentu na podstawie wykonanych symulacji
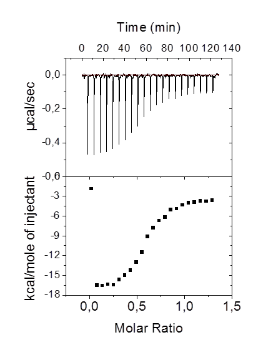
Jak wybrać warunki aby eksperyment wyglądał jak na Rys. Figure 1?
Problemem jest dobór stężenia makromolekuły i ligandu, tak aby mierzony efekt był wystarczająco silny.
Parametr sigmoidalności
Parametr sigmoidalności zdefiniowany jest następująco:
- [math]C = K_\mathrm{eq} [P]_t\;[/math]
gdzie: [math][P]_t\;[/math] — całkowite stężenie makromolekuł w roztworze, [math]K_\mathrm{eq}\;[/math] — szacowana stała równowagi.
Parametr [math]C\;[/math] powinien mieścić się w zakresie: [math]10 \lt C \lt 1000 \;[/math].
- Jeśli [math]K_\mathrm{eq}\;[/math] jest zbyt małe [math](\lt \unit{10^{-4}}{\frac 1 M})\;[/math] kłopoty z osiągnięciem odpowiedniego stężenia makromolekuł.
- Jeśli [math]K_\mathrm{eq}\;[/math] jest zbyt duże [math](\gt \unit{10^9}{\frac 1 M})\;[/math], stężenie makromolekuł może być zbyt niskie.
- Dla [math]C \gt 1000\;[/math] nie można wyznaczyć stałej wiązania — poważne ograniczenie metody ITC do badania potencjalnych leków, ze względu na poszukiwania ekstremalnie silnie wiążących się inhibitorów.
Co zrobić jeśli nie można wyznaczyć bezpośrednio parametrów termodynamicznych?
Wykorzystuje się konkurencję ligandów o miejsce wiążące w makromolekule.
- Miareczkowanie słabym inhibitorem i określenie parametrów termodynamicznych.
- Miareczkowanie silnym inhibitorem i określenie entalpii.
- Wypychanie słabego inhibitora przez silny inhibitor.
- Wyznaczenie stałej inhibicji dla silnego inhibitora z zależności:
- [math]K_\mathrm{app}=\frac{K_B}{(1+K_A)[A]}\;[/math]
gdzie: [math]K_A\;[/math] — stała wiązania dla słabego inhibitora, [math]K_B\;[/math] — stała wiązania dla silnego inhibitora, [math]K_\mathrm{app}\;[/math] — pozorna stała wiązania (uzyskana z pomiarów wypychania), [math][A]\;[/math] — stężenie słabego inhibitora dostosowane tak, aby wyznaczyć [math]K_\mathrm{app}\;[/math].
Zebranie danych pomiarowych
Należy:
- Wyznaczyć stężenie ligandów i makromolekuł z najwyższą możliwą dokładnością (np. metodami spektrofotometrycznymi).
- Ze względu na możliwość istnienia efektów cieplnych związanych z mieszaniem roztworów o różnym składzie bufor w celce pomiarowej i w strzykawce powinien być identyczny (dializa roztworu makromolekuł i wykorzystanie buforu po dializie do przygotowania roztworu ligandu!).
- Określić metodę pomiarową:
- Liczba wstrzyknięć.
- Objętość każdego wstrzyknięcia.
- Stężenie ligandu w nastrzykach.
- Odstęp czasowy pomiędzy kolejnymi wstrzyknięciami.
- Zrównoważyć termicznie roztwór makromolekul i liganda i wykonać pomiar
Mierzymy [math]\Delta H\;[/math] związane z dodawaniem kolejnych porcji liganda i wszystkimi zmianami takimi jak tworzenie wiązań, oddziaływanie z buforem, jonizacja, dlatego potrzebne są, dla tych samych warunków wstrzyknięć pomiary kontrolne, to znaczy wyznaczenie
- Ciepła rozcieńczania ligandu — miareczkowanie ligandem buforu.
- Ciepła rozcieńczania makromolekuł — miareczkowanie buforem roztworu makromolekuł (zwykle do zaniedbania).
- Miareczkowanie buforu buforem. Nanosimy poprawki na wartość sygnału mierzonego w reakcji: [math]Q_\mathrm{corr}=Q_\mathrm{pomiar}-Q_\mathrm{r,lig}-Q_\mathrm{r,mo}l-Q_\mathrm{r,buf}\;[/math]
- Należy usunąć gaz z roztworów (odgazowywać).
Przepływ protonów
Dodatkowo trzeba zwrócić na uwagę na ciepło jonizacji buforu przez protony uwalniane w reakcji (należy porównywać różne bufory):
- [math]Q_\mathrm{corr}=Q_\mathrm{pomiar}-(\Delta H_\mathrm{jon} \cdot n_\mathrm{p})\;[/math]
[math]n_\mathrm{p}\;[/math] — ilość protonów uwalnianych po związaniu 1 mola ligandów.
- Acetate 0,1 kcal/mol.
- MES 3,7 kcal/mol.
- ACES 7,5 kcal/mol.
Analiza danych kalorymetrycznych
Założenie określonego modelu reakcji dla makromolekuły, np. :
- Jedno miejsce wiążące (lub [math]n\;[/math] identycznych miejsc).
- Dwa niezależne miejsca wiążące.
- Wiązanie sekwencyjne.
Dopasowanie matematycznego modelu do danych eksperymentalnych (ITC software) z podawanymi szacunkowymi wartościami wyjściowymi poszukiwanych parametrów.
Poszukiwanie najprostszego modelu, który w ramach błędu pomiarowego opisze obserwowane miareczkowanie (poda np. wartości K, [math]\Delta H\;[/math], n).
Przykłady
- Identyczne, nieoddziałujące miejsca wiązania ligandu:
- [math]K_a = \frac{\Theta}{(1-\Theta)[L]},\ [L]_\mathrm{tot} = [L]_\mathrm{free} + n[P]_\mathrm{tot}\Theta\;[/math]
- Dwa typy niezależnych miejsc wiązania ligandu:
- [math]K_1 = \frac{\Theta_1}{(1-\Theta_1)[L]},\ K_2 = \frac{\Theta_2}{(1-\Theta_2)[L]}\;[/math]
- Wiązanie sekwencyjne ligandów
- [math]K_1 = \frac{[PL]}{[P][L]},\ K_2=\frac{[PL_2]}{[PL][L]},\ K_3=\frac{[PL_3]}{[PL_2][L]}\;[/math]
Metody rozwiązań powyższych zależności są dostarczane jako oprogramowanie wraz z kalorymetrami.
Krytyczna analiza wyników — czy są „fizyczne”, czy wybrano najprostszy model, czy kryterium zbieżności jest spełnione itp.
ITC — enzymatyczne eksperymenty kinetyczne
- [math]K_M = \frac{k_{-1}+k_2}{k_1}\;[/math]
- [math]K_\mathrm{eq} = \frac{[ES]}{[E][S]} \approx \frac 1 {K_M}\;[/math]
- [math]k_\mathrm{cat} = \frac{v_\max}{[E]_t}\;[/math]
- [math]v_0 = v_\max \frac{[S]}{K_M+[S]}=\frac{k_\mathrm{cat}[E]_t[S]}{K_M+[S]}\;[/math]
Bezpośredni pomiar szybkości reakcji
- [math]\frac{\partial Q}{\partial t} = \frac{\partial n}{\partial t}\cdot \Delta H\;[/math].
Pojedyncze wstrzyknięcie
Stężenie wstrzykiwanego substratu powinno umożliwić wydzielenie ciepła większe niż 10 μcal/s. Wyznaczenie [math]\Delta H\;[/math] z pojedynczego pomiaru.
Wielokrotne wstrzyknięcia
Stężenie wstrzykiwanego substratu w każdym kroku powinno umożliwić wydzielenie ciepła większe niż 2 μcal/s.
Wielokrotne wstrzyknięcia po uzyskaniu plateau — umożliwiają wyznaczenie szybkości reakcji w funkcji stężenia substratu i dokładniejsze wyznaczenie parametrów kinetycznych niż przy jednokrotnym wstrzyknięciu. Nie ma możliwości wyznaczenia w pierwszym kroku [math]\Delta H\;[/math].
Projektowanie enzymatycznego eksperymentu kinetycznego
- Podobnie jak w przypadku miareczkowania ITC wykonanie ślepych prób,
- dializa białka i przygotowanie ligandu w buforze po dializie,
- ale: większe różnice pomiędzy nastrzykami (minuty, nie sekundy).
- Dobranie stężeń białka i ligandu tak, aby [math]\Delta H\;[/math] było wyraźnie.
Dla pojedynczego nastrzyku stężenie enzymu powinno umożliwić zakończenie reakcji w ciągu 1 godz. (typowo 1 nM — 10 μM). Stężenie substratu powinno być wielokrotnie większe niż enzymu (103-104 raza) i większe niż [math]K_M\;[/math]. Objętość pojedynczego nastrzyku 25-50 μl. Objętość dla wielokrotnych nastrzyków 2-5 μl.
Analiza danych za pomocą soft ware’u dostarczonego z kalorymetrem.
DSC — różnicowa kalorymetria skaningowa (Differential Scanning Calorimetry)
- Znajduje zastosowanie przy badaniu stabilności białek, lipidów, przejść fazowych, kwasów nukleinowych .
- Pozwala na uzyskanie większości parametrów termodynamicznych.
Eksperyment DSC
- Próbka zawiera ok. 2 ml białka o stężeniu 1-5 mg/ml.
- Próbka referencyjna zawiera tylko bufor.
- Próbki są jednocześnie ogrzewane lub ochładzane.
- Pomiędzy celkami pomiarową i referencyjną znajduje się czujnik, który mierzy różnicę temperatur pojawiającą się w trakcie zachodzenia procesu i dostarcza napięcie, w celu utrzymania jednakowej temperatury obydwu celek.
- Sygnał proporcjonalny do różnicowo dostarczonego napięcia jest zapisywany jako funkcja temperatury.
- Eksperyment jest zwykle powtarzany kilka razy a przebiegi uśredniane, umożliwiając wyznaczenie zmiany entalpi procesu takiego jak unfolding, tworzenie kompleksów, wiązanie ligandów, itp.
- Zakres temperatur zwykle -10°C — 130°C.
- Możliwość stosowania dla szerokiego zakresu stężeń białek.
- DSC umożliwia pomiary [math]C_p\;[/math] w funkcji temperatury. Użyteczne w określaniu parametrów, które zmieniają się wraz ze zmianą temperatury.
- Zwykle zmiany [math]C_p\;[/math] są niewielkie, trzeba porównywać uzyskane efekty względem celki referencyjnej i powtarzać pomiary.
Zastosowania DSC
Wszystkie procesy indukowane przez zmianę temperatury:
- Przejście podwójna — pojedyncza helisa DNA.
- Rozfałdowywanie białek.
- Rozpad oligomerów na podjednostki.
- Zmiany w funkcji pH, siły jonowej itp. (warunki stabilizujące lub nie — białko).
- Porównania mutantów.
- Oddziaływania międzycząsteczkowe białek, wielocukrów i nie-biologicznych polimerów.
Schemat denaturacji białka
- [math]K_\mathrm{den} = \frac{[D]}{[N]}\;[/math]
- [math]\Delta G_\mathrm{den} = -RT\ln K_\mathrm{den}\;[/math]
[math]K_\mathrm{den}(T)\;[/math] — stała równowagi pomiędzy zdenaturowaną i natywną frakcją białka w temp. [math]T\;[/math].
Pamiętamy, że: [math]\Delta C_p\;[/math] — zmiana pojemności cieplnej związana z określonym procesem
- [math]\Delta H = \int\Delta C_p(T)\mathrm dT\;[/math]
- [math]\Delta S = \int\frac{\Delta C_p(T)}T\mathrm dT\;[/math]
Z wykresu [math]C_p(T)\;[/math] możemy wyznaczyć: [math]T_\mathrm{p.f.}\;[/math] , [math]\Delta C_p\;[/math], oraz:
- [math]\Delta H_{D-N} = \int \Delta C_p(T)\mathrm dT\;[/math]
- [math]\Delta S_{D-N} = \int\frac{\Delta C_p(T)}T\mathrm dT\;[/math]
- [math]\Delta G_{D-N} =\Delta H_{D-N} - T\Delta S_{D-N} \;[/math]
skoro:
- [math]\Delta G_\mathrm{den} = -RT\ln K_\mathrm{den}\;[/math]
to:
- [math]K_\mathrm{den} = \frac{[D]}{[N]}\;[/math].
Krzywa zależności [math]C_p(T)\;[/math] może pokazywać ilość stanów pośrednich w czasie zwijania/rozwijania białka.