Pracownia Podstaw Biofizyki/PPB4
Badanie kompleksowania jonów wapnia z EDTA metodą izotermicznego miareczkowania kalorymetrycznego dr Beata Wielgus-Kutrowska
Spis treści
Wstęp
Wszystkim procesom chemicznym i biochemicznym, w których powstają lub ulegają rozerwaniu wiązania oraz ulega zmianie hydratacja grup polarnych i niepolarnych cząsteczek towarzyszy wydzielanie bądź pochłanianie ciepła. Pomiar parametrów termodynamicznych charakteryzujących taki proces pozwala opisać zachodzące zjawiska. Ma to znaczenie nie tylko poznawcze, ale i praktyczne, np. w badaniach opisujących właściwości leków.
Kalorymetria umożliwia bezpośredni, ilościowy pomiar wymiany cieplnej z otoczeniem wynikającej z zachodzących procesów chemicznych i fizycznych. W przeciwieństwie do metod pośrednich, wymagających szczególnych cech biocząsteczek, (naturalnych lub nabywanych poprzez ich modyfikację, np. dołączanie znaczników spektroskopowych), technika ta pozwala na bezpośredni pomiar parametrów opisujących zmianę stanu układu. Można ją zastosować do badania dowolnej molekularnej reakcji w przypadku przezroczystych i mętnych roztworów oraz zawiesin, brak jest też zwykle ograniczeń dotyczących masy cząsteczek i składu buforu. Ze względu na powyższe zalety kalorymetria jest rutynowo stosowana w badaniach wzajemnych oddziaływań i zmianach konformacji szerokiego zakresu biopolimerów, w tym białek, kwasów nukleinowych i lipidów.
Cel ćwiczenia:
- Zapoznanie się z wybraną kalorymetryczną techniką pomiarową (ITC),
- poznanie zasady działania i obsługi kalorymetru ,
- przeprowadzenie typowego eksperymentu kalorymetrycznego polegającego na obserwacji zmian cieplnych zachodzących w trakcie kompleksowania cząsteczek chemicznych,
- wyznaczenie parametrów termodynamicznych procesu,
- dyskusja wyników.
Typy eksperymentów kalorymetrycznych
Rozróżniamy dwa rodzaje technik kalorymetrycznych:
- skaningowa kalorymetria różnicowa, DSC (ang. differential scanning calorimetry),
- izotermiczna kalorymetria miareczkująca ITC (izothermal titration calorimetry).
Różnicowa kalorymetria skanująca (DSC)
DSC umożliwia pomiar zmian fazowych zachodzących w biopolimerach inicjowanych dostarczeniem ciepła. W związku z tym ma zastosowanie w badaniach zjawisk indukowanych przez zmianę temperatury, do których należą m.in.: przejście podwójna — pojedyncza helisa DNA, rozfałdowywanie białek, rozpad oligomerów na podjednostki, porównanie stabilności mutantów, oddziaływania międzycząsteczkowe białek, wielocukrów i nie-biologicznych polimerów.
DSC pozwala na uzyskanie następujących parametrów termodynamicznych:
- entalpia rozfałdowywania [math](\Delta H)\;[/math], wynikająca z wydzielanego ciepła denaturacji,
- temperatura przejścia fazowego [math](T_\mathrm{p.f.})\;[/math] odpowiadającą stanowi, w którym 50% biomolekuł jest w stanie rozwiniętym, im wyższa temperatura przejścia tym bardziej stabilna biomolekuła,
- zmiana pojemności cieplnej denaturacji [math](\Delta C_\text{p})\;[/math], spowodowana zmianami w uwodnieniu łańcuchów bocznych ukrytych, w stanie aktywnym biologicznie, we wnętrzu biomolekuł, które ulegają wyeksponowaniu w stanie zdenaturowanym.
W typowym eksperymencie DSC jedna z celek (referencyjna) jest wypełniona buforem, druga zawiera roztwór biomolekuł w tym samym buforze. Celki są stopniowo podgrzewane ze stała prędkością. Mierzy się wydzielane ciepło powstające w wyniku termicznej denaturacji cząsteczek. Z wykresu [math]C_\text{p}(T)\;[/math] możemy wyznaczyć: [math]T_\mathrm{p.f.}\;[/math], [math]\Delta C_\text{p}\;[/math] i dalej zmiany entalpii, entropii, energii swobodnej Gibbsa i stałą równowagową procesu (patrz wykład ”Metody Biofizyki Molekularnej”).
Izotermiczna kalorymetria miareczkująca (ITC)
W typowym eksperymencie ITC mierzone jest ciepło wydzielające się w trakcie reakcji biochemicznej. ITC znajduje zastosowanie w badaniach biofizycznych takich jak:
- asocjacje i mechanizm oddziaływań biomolekuł (małych cząsteczek, białek z ligandami i innymi białkami, przeciwciał z antygenami, kwasów nukleinowych, lipidów, itp.),
- wpływ zmian struktury cząsteczek na mechanizmy wiązania (mutanty białkowe),
- badania aktywności biologicznej i kinetyka reakcji enzymatycznych.
Pomiary wydzielanego ciepła umożliwiają dokładne wyznaczenie stałej wiązania [math](K_\text{as})\;[/math], stechiometrii reakcji [math](N)\;[/math], zmiany entalpii [math](\Delta H)\;[/math] i entropii [math](\Delta S)\;[/math] i umożliwiają pełny opis termodynamiczny oddziaływań międzycząsteczkowych.
Uwaga
- Należy pamiętać, że otrzymane parametry zależą od warunków pomiaru, np. temperatury.
- Ograniczeniem metody mogą być zbyt niskie stężenia białek i związana z tym mała wartość emitowanego lub pochłanianego ciepła.
Zalety ITC to pomiar bezpośredni ciepła wydzielanego w reakcji, możliwość wyznaczania parametrów w szerokim zakresie, możliwość badania dowolnej molekularnej reakcji, zwykle brak ograniczeń dotyczących masy cząsteczek.
Etapy typowego eksperymentu ITC
Typowy eksperyment ITC obejmuje następujące etapy:
- Zaplanowanie eksperymentu na podstawie wykonanych symulacji. Istotną rolę odgrywa tu właściwe dobranie stężeń biopolimeru i ligandu w oparciu o szacowaną wartość stałej asocjacji [math](K_\text{as})\;[/math] oraz parametr sigmoidalności [math]C\;[/math] zdefiniowany jako [math]C = K_\text{eq} [P]_t\;[/math], gdzie [math][P]_t\;[/math] oznacza całkowite stężenie makromolekuł w roztworze, a [math]K_\text{eq}\;[/math] szacowaną stałą równowagi.
Aby kształt krzywej miareczkowania umożliwił jak najdokładniejsze wyznaczenie parametrów termodynamicznych parametr [math]C\;[/math] powinien mieścić się w zakresie [math]10 \lt C \lt 1000\;[/math]. - Przygotowanie roztworu ligandu i makromolekuł zgodnie z zaplanowanymi stężeniami.
- Zebranie danych pomiarowych. Miareczkowanie ITC odbywa się poprzez wielokrotne, stopniowe, ze stałym interwałem czasowym, wprowadzanie niewielkich ilości jednego reagenta do celki z drugim reagentem, aż do zakończenia procesu.
- Wykonanie pomiarów kontrolnych, tzw. ślepa próba (np. bufor — jeden z reagentów).
- Analiza danych, z uwzględnieniem poprawek związanych z wykonaniem ślepej próby i wyznaczenie parametrów termodynamicznych.
- Krytyczna interpretacja wyników.
Budowa części pomiarowej kalorymetru ITC
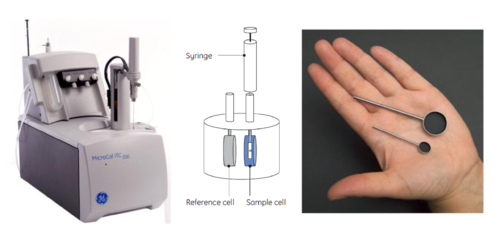
Nowoczesny nanokalorymetr ITC jest przedstawiony na Rys. Figure 1. Najważniejszą częścią aparatu są celki odniesienia, zawierająca bufor i pomiarowa. Zainstalowany czujnik temperatury umożliwia termiczne zrównoważenie celek przed eksperymentem. Strzykawka sterowana komputerowo pozwala na dodawanie do celki pomiarowej z reagentem roztworu z drugim reagentem o określonej objętości w określonych odstępach czasowych. Pomiar ciepła wydzielanego lub pochłanianego w reakcji odbywa się metodą kompensacji mocy. Polega ona na utrzymywaniu celki pomiarowej w stałej temperaturze, dzięki zastosowaniu odpowiedniego kontrolera, który chłodzi lub grzeje celkę w trakcie zachodzącej reakcji. Sygnałem pomiarowym jest moc (μcal/s, μJ/s) potrzebna do utrzymania celki w stałej temperaturze (takiej samej jak temperatura celki referencyjnej), która jest przeliczana na ciepło emitowane lub pochłaniane w trakcie reakcji.
W wyniku pomiarów uzyskuje się t.zw. termogram. Analiza danych eksperymentalnych za pomocą dedykowanego programu umożliwia wyznaczenie parametrów termodynamicznych.
Parametry termodynamiczne uzyskiwane w pomiarach ITC
Dokładne omówienie parametrów termodynamicznych można znaleźć w literaturze.
Dla najprostszej reakcji asocjacji
- [math]A \overset{k_\text{on}}\underset{k_\text{off}}\Longleftrightarrow B\;[/math].
Stałą dysocjacji definiujemy jako:
- [math]K_\text{d} = \frac{[A][B]}{[AB]}\;[/math].
Jest ona odwrotnością stałej asocjacji.
Stechiometria [math]N\;[/math] — opisująca w jakich proporcjach ilościowych reagują z sobą związki chemiczne.
Entalpia swobodna (energia swobodna Gibbsa), w stanie równowagi opisywana jest jako:
- [math]\Delta G^0 = -RT\ln K_\text{eq} = RT\ln K_\text{d}\;[/math],
gdzie: [math]R\;[/math] — stała gazowa, [math]T\;[/math] — temperatura.
Dla reakcji samorzutnych [math]\Delta G\;[/math] ma wartość ujemną. Entalpia swobodna wyraża tendencję obiektów do osiągnięcia stanu o najniższej energii (ujemna wartość zmiany entalpii ∆H) i wzrostu stopnia nieuporządkowania (dodatnia wartość zmiany entropii [math](\Delta S)\;[/math]. Wiąże się ona z entalpią i entropią następującą zależnością:
- [math]\Delta G = \Delta H -T\Delta S\;[/math].
Sama entalpia swobodna niewiele mówi o siłach stabilizujących kompleks białkowy. Parametrami termodynamicznymi charakteryzującymi oddziaływania makrocząsteczek są:
- entalpia, której zmiany wynikają z reorganizacji oddziaływań międzycząsteczkowych, tworzenia nowych oddziaływań, zmiany hydratacji grup polarnych i niepolarnych oraz
- entropia, opisująca naturalna tendencje układu do uzyskania stanu o największym stopniu nieuporządkowania będąca sumą zmian entropii hydratacji, entropii konformacyjnej i dynamiki wiązań oraz entropii związanej z translacją i rotacją cząstek po utworzeniu kompleksu.
Najbardziej pożądaną sytuacją przy tworzeniu kompleksów biomolekularnych jest możliwie najniższa wartość [math]\Delta H\;[/math] i czynnika entropowego — [math]T\Delta S\;[/math].
Warunki przystąpienia do części eksperymentalnej ćwiczenia
Warunkiem przystąpienia do części eksperymentalnej jest zaliczenie kolokwium wstępnego. Wybór sposobu przeprowadzenia kolokwium wstępnego należy do prowadzącego ćwiczenie. Materiał z zakresu kalorymetrii obowiązujący w czasie kolokwium wstępnego i wykonywania części eksperymentalnej ćwiczenia został przedstawiony w niniejszej instrukcji, podczas wykładu „Metody Biofizyki Molekularnej” oraz w umieszczonej na końcu instrukcji bibliografii.
Na kolokwium wstępnym mogą pojawić się następujące zagadnienia:
- Porównanie technik eksperymentalnych DSC i ITC. W jakich pomiarach znajdują zastosowanie? Jakie parametry termodynamiczne możemy dzięki nim uzyskać?
- Czym różnią się reakcje endo- i egzotermiczne? Co jest przyczyną wydzielania bądź pochłaniania ciepła w trakcie zachodzących reakcji biochemicznych makromolekuła — ligand? Na co spożytkowane zostaje ciepło pochłaniane podczas denaturacji białek?
- Definicja wielkości wyznaczanych w pomiarach kalorymetrycznych: entalpia, entropia, entalpia swobodna (energia swobodna Gibbsa), stechiometria [math]N\;[/math], stała dysocjacji/asocjacji [math]\nicefrac{K_\text{d}}{K_\text{as}}\;[/math].
- Etapy eksperymentu ITC. Co to jest parametr [math]C\;[/math]? Jakie ma znaczenie przy projektowaniu eksperymentu?
- Opisz najważniejsze części kalorymetru ITC. Co i w jaki sposób mierzy się w trakcie eksperymentu?
Wykonanie eksperymentu
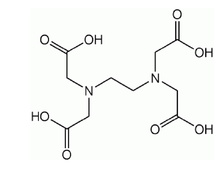
W ćwiczeniu będziemy obserwować kompleksowanie EDTA (kwas etylenodiaminotetraoctowy ang. ethylenediaminetetraacetate, Rys. Figure 2) z chlorkiem wapnia.
Jest to reakcja egzotermiczna przebiegająca zgodnie ze schematem:
- Ca2++EDTA(aq) →[Ca2+EDTA]
Ustalimy stechiometrię wiązania, entalpię, entropię, stałą asocjacji i energię swobodna Gibbsa.
Do dyspozycji mamy 10 mM bufor MES o pH 5,6, roztwór EDTA o stężeniu 5 mM w 10 mM buforze MES pH 5,6, oraz roztwór chlorku wapnia o stężeniu 50 mM.
Etapy wykonania eksperymentu
- Przygotowanie układu pomiarowego odbywa się pod kierunkiem asystenta (w zależności od stosowanego kalorymetru część etapów przygotowania układu pomiarowego wykonuje asystent).
- Zakładając stała asocjacji równą 1,24∙105 M-1 wyznaczyć parametr [math]C\;[/math].
- Przygotować roztwory w buforze MES o odpowiednim stężeniu rozcieńczając wyjściowe roztwory EDTA (stężenie końcowe 0,4 mM, [math]V = \unit{500}{\mu l}\;[/math]) i chlorku wapnia (stężenie końcowe 5 mM, [math]V =\unit{ 100}{ \mu l}\;[/math]).
- Odgazować przygotowane roztwory.
- Przedyskutować z asystentem i zanotować ustawienia kalorymetru.
Parametr Ustawienia Parametr Ustawienia Liczba wstrzyknięć
(Number of Injections)Objętość pierwszego wstrzyknięcia
(Volume 1st Injection)Temperatura celki
(Cell Temperature)Czas trwania pierwszego wstrzyknięcia
(Duration 1st Injection)Moc odniesienia
(Reference Power)Objętość kolejnych wstrzyknięć
(Volume after 1st Injection)Opóźnienie początkowe
(Initial Delay)Czas trwania kolejnych wstrzyknięć
(Duration after 1st Injection)Steżenie BrCl2 w strzykawce
(Syringe Concentration)Przerwa między wstrzyknięciami
(Injection Spacing)Stężenie eteru koronowego w celce
(Cell Concentration)Czas reakcji aparatu
(Filter Period)Prędkość mieszania
(Stirrer Speed)Sprzężenie zwrotne — tryb pracy
(Feedback Mode/Gain)Sposób równoważenia aparatu
(ITC Equilibration Options) - Wykonać pomiar (EDTA miareczkowane chlorkiem wapnia)
- Jeśli termogram nie zawiera wyraźnych plateau początkowego i końcowego powtórzyć eksperyment dla innych stężeń reagentów (opcjonalnie, jeśli krzywa miareczkowania wygląda prawidłowo można powtórzyć eksperyment w innej temperaturze).
- Ewentualnie wykonać pomiar kontrolny (bufor MES miareczkowany chlorkiem wapnia).
- Po zakończeniu eksperymentu umyć układ pomiarowy.
- Opracować wyniki, wyznaczając parametry termodynamiczne, stałą asocjacji oraz stechiometrię.
- Porównać uzyskane dane z danymi literaturowymi.
- Opisać i zinterpretować uzyskane wyniki.
Czy uzyskane wyniki są zgodne z danymi literaturowymi[1]? Co może być przyczyną rozbieżności? Jaki wpływ na wyniki ma dobór parametru [math]C\;[/math]? Jaki wpływ na wyniki ma temperatura?
Literatura
- John E. Ladbury (Editor), Michael L. Doyle (Editor), Biocalorimetry 2: Applications of Calorimetry in the Biological Sciences
- Matthew W. Freyer and Edwin A. Lewis, Methods in Cell Biology, 84 (2008), Isothermal Titration Calorimetry: Experimental Design, Data Analysis, and Probing Macromolecule/Ligand Binding and Kinetic Interactions
- Davis Sheeman — Physical Biochemistry: Principles and Applications, wyd. John Wiley and Sons, Inc., 2000
- Igor N. Serdyuk, Nathan R. Zaccai and Joseph Zaccai, Methods in Molecular Biophysics. Structure, Dynamics, Function, wyd. Cambridge University Press, 2007
- Wykład „Metody Biofizyki Molekularnej” — Kalorymetria
- ↑ Dane literaturowe pochodzące z instrukcji wydanej przez firmę MicroCal: [math]K_a=\unit{1,24\cdot 10^5} M (\pm 20\%)\;[/math] [math] N=0.966 (\pm 5 \%)\;[/math] [math]\Delta H=\unit{-4120}{ \frac{cal}{mol}} (\pm 10\%)\;[/math]