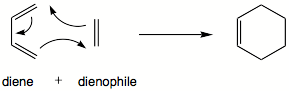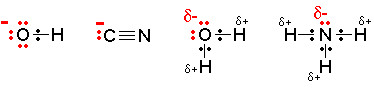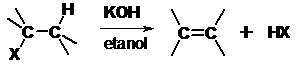PCzEB/Przeglad wlasciwosci najwazniejszych grup związkow organicznych I
ALKANY
Są to węglowodory nasycone o ogólnym wzorze [math]\mathrm{C}_n\mathrm{H}_{2n+2}[/math]; Wszystkie atomy węgla w alkanach mają hybrydyzację [math]sp^3[/math]. Alkany to związki bez grup funkcyjnych.
Nazewnictwo
- dla pierwszych czterech alkanów — od [math]\mathrm{C}_1[/math] do [math]\mathrm{C}_4[/math] używa się nazw zwyczajowych:
CH4 C2H6 C3H8 C4H10 metan etan propan butan - Nazwy alkanów od [math]\mathrm{C}_5[/math] wzwyż tworzy się poprzez dodanie końcówki „n” do liczebników greckich lub łacińskich, np.: pentan (5); heksan (6); heptan (7), oktan (8); nonan (9); dekan (10); undekan (11); dodekan (12); tridekan (13); tetradekan (14), etc.
Nazwy te odnoszą się do alkanów prostołańcuchowych, czyli tzw. normalnych. Jeżeli chcemy zaznaczyć ten fakt, to nazwę poprzedzamy „n” — pisaną kursywą, np.: n-butan.
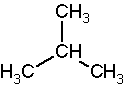
W węglowodorach rozgałęzionych podajemy nazwy łańcuchów bocznych, które poprzedzają lokanty, czyli numery atomów węgla łańcucha głównego (najdłuższego), z którymi związane są łańcuchy boczne, np. nazwa 2-metylopropan oznacza, że przy drugim atomie węgla propanu znajduje się reszta metylowa, czyli [math]\mathrm{CH}_3[/math]:
Reguły nazewnictwa:
- tworzenie nazwy rozgałęzionego alkanu rozpoczyna się od identyfikacji najdłuższego łańcucha, który jako łańcuch główny będzie podstawą nazwy rdzenia;
- lokanty (liczby określające położenie podstawników w łańcuchu — numery atomów) należy tak przypisywać, żeby podstawnik otrzymał możliwie najniższą wartość;
- nazwy podstawników zajmują w nazwie związku miejsca zgodnie z kolejnością alfabetyczną, przy czym bierze się pod uwagę pierwszą literę podstawnika, a nie liczebnika określającego liczbę tych podstawników.
Właściwości chemiczne alkanów
Reakcje wolnorodnikowe
W tego typu reakcjach możemy wyróżnić trzy etapy:
- etap inicjacji — etap wytworzenia rodnika (rodniki powstają np. na skutek homolitycznego rozpadu wiązań chemicznych, tj. takiego, w wyniku którego przy obu częściach rozerwanej cząsteczki zostaje po jednym z elektronów, które wcześniej tworzyły wiązanie). Typowy przykład reakcji, w wyniku której powstają rodniki to np. rozpad cząsteczek chloru [math]\mathrm{Cl}_2[/math] pod wpływem działania światła ultrafioletowego:
[math]\mathrm{Cl}_2 +\ h\nu\ \rightarrow\ 2 \mathrm{Cl}\cdot[/math] - etap propagacji łańcucha: wolne rodniki chloru reagują np z metanem, tworząc rodnik metylowy, który następnie w reakcji z kolejną cząsteczką chloru tworzy produkt (jeden z wielu) reakcji chlorowania i kolejny wolny rodnik zdolny do dalszych etapów:
[math]\mathrm{CH}_4+\mathrm{Cl}\cdot \rightarrow \mathrm{CH}_3 + \mathrm{HCl}[/math] [math]\mathrm{CH}_3\cdot+\mathrm{Cl}_2 \rightarrow \mathrm{CH}_3\mathrm{Cl} + \mathrm{Cl}\cdot[/math] [math]\mathrm{CH}_3\mathrm{Cl}+\mathrm{Cl} \cdot\rightarrow \mathrm{CH}_2\mathrm{Cl}\cdot + \mathrm{HCl}[/math] [math]\mathrm{CH}_2\mathrm{Cl}\cdot+\mathrm{Cl}_2 \rightarrow \mathrm{CH}_2\mathrm{Cl}_2 + \mathrm{Cl}\cdot[/math] itd.. Chlorowanie przebiega do mono- i wielopodstawionych chloropochodnych metanu
[math]\mathrm{CH}_3\mathrm{Cl}[/math], [math]\mathrm{CH}_2\mathrm{Cl}_2[/math], [math]\mathrm{CH}\mathrm{Cl}_3[/math] oraz [math]\mathrm{C}\mathrm{Cl}_4[/math]. - etap zakończenia (terminacji) łańcucha reakcji — może zajść na wiele sposobów; najczęściej jest to spowodowane rekombinacją dwóch wolnych rodników, która prowadzi do powstania niereaktywnych cząsteczek:
[math]\mathrm{CH}_3\cdot + \mathrm{Cl}\cdot \rightarrow \mathrm{CH}_3\mathrm{Cl}[/math] [math]\mathrm{Cl}\cdot + \mathrm{Cl}\cdot \rightarrow \mathrm{Cl}_2[/math] [math]\mathrm{CH}_3\cdot + \mathrm{CH}_3\cdot \rightarrow \mathrm{C}_2\mathrm{H}_6[/math]
Zastosowanie
Węglowodory nasycone są bardzo ważnym źródłem energii. Węglowodory o łańcuchach o długości od 5 do 10 atomów węgla wchodzą w skład benzyn, ważnych paliw płynnych. Całkowite spalanie 2 moli oktanu prowadzi do powstawania dwutlenku węgla oraz wody i dostarcza ponad 10 MJ energii:
Problem pojawia się, gdy węglowodory ulegają półspalaniu, a produktem reakcji jest wtedy toksyczny tlenek węgla [math]2\mathrm{CO}[/math].
W przypadku silników samochodowych, rozwiązaniem jest zastosowanie katalizatorów samochodowych (reaktorów katalitycznych, konwerterów), które zmniejszają ilość szkodliwych składników spalin, a działanie ich opiera się na reakcji substancji zawartych w spalinach z katalizatorem ([math]\mathrm{Pt/Pd}[/math], [math]\mathrm{Rh}[/math]). Mamy tu do czynienia z szeregiem procesów oksydacyjno–redukcyjnych, w tym z dotlenieniem gazów silnikowych, ale też konwersją typu:
W układach biologicznych problem tlenku węgla [math]\mathrm{CO}[/math] jest poważniejszy.
Cząsteczkę tlenku węgla możemy zapisać w postaci trzech struktur mezomerycznych, każda z tych struktur może mieć różny udział w strukturze końcowej.
Pierwsza ze struktur wyraźnie wskazuje, że cząsteczka tlenku węgla jest zasadą Lewisa, a więc wchodzi w reakcje ze związkami o charakterze kwasu Lewisa, np. hemoglobiną (w centrum układu porfirynowego hemoglobiny jest jon [math]\mathrm{Fe}^{+2}[/math]). Reakcja tlenku węgla z hemoglobiną jest reakcją konkurencyjną do tworzenia kompleksu hemoglobina-tlen, przy czym kompleks hemoglobiny z tlenkiem węgla jest znacznie trwalszy, stąd też zatrucie [math]\mathrm{CO}[/math] jest bardzo niebezpieczne (mówimy, że [math]\mathrm{CO}[/math] jest hematotoksyczny).
Głównym źródłem węglowodorów nasyconych jest ropa naftowa (metan jest natomiast podstawowym składnikiem gazu ziemnego, czasem, ale nie zawsze, towarzyszącego ropie - stąd wiązanie cen gazu i ropy jest ryzykowne). Wyróżniamy różne frakcje ropy naftowej w zależności od temperatury wrzenia destylowanej frakcji i liczby atomów węgla. Warto tu wspomnieć o wkładzie Ignacego Łukasiewicza w rozwój petrochemii.
| Frakcja | Temp. destylacji (°C) | Liczba atomów węgla |
|---|---|---|
| gaz | <20 | [math]\mathrm{C}_1[/math] — [math]\mathrm{C}_4[/math] |
| eter naftowy | 20—60 | [math]\mathrm{C}_5[/math] — [math]\mathrm{C}_6[/math] |
| ligroina (lekka nafta) | 60—100 | [math]\mathrm{C}_6[/math] — [math]\mathrm{C}_7[/math] |
| gazolina surowa (benzyna) | 20—205 | [math]\mathrm{C}_5[/math] — [math]\mathrm{C}_{10}[/math] i cykloalkany |
| nafta | 175—325 | [math]\mathrm{C}_{12}[/math] — [math]\mathrm{C}_{18}[/math] i związki aromatyczne |
| olej gazowy | >275 | [math]\mathrm{C}_{12}[/math] i wyższe |
| olej smarowy | nielotna ciecz | powyżej [math]\mathrm{C}_{18}[/math] |
| asfalt lub koks naftowy | nielotne ciało stałe | związki wielopierścieniowe |
Inny podział uwzględniający zakres temperatury destylacji odpowiada użyteczności danej frakcji ropy naftowej:
| Frakcja | Temperatura destylacji (°C) |
|---|---|
| Benzyna lekka | 40—160 |
| benzyna ciężka | 160—200 |
| nafta | 180—280 |
| olej napędowy | 280—350 |
| mazut | >350 |
Paliwa stosowane w silnikach iskrowych to mieszaniny węglowodorów,
których pierwotnym źródłem jest głównie ropa naftowa. Różne
węglowodory zawarte w benzynie mają różną liczbę oktanową.
Liczba oktanowa
liczba określająca odporność na niekontrolowany samozapłon paliwa silnikowego do silników z zapłonem iskrowym, który może powodować jego spalanie detonacyjne (stukowe), bardzo szkodliwe dla silnika.
|
[math]\mathrm{H_3C}-\mathrm{CH_2}-\mathrm{CH_2}-\mathrm{CH_2}-\mathrm{CH_2}-\mathrm{CH_2}-\mathrm{CH_3}[/math] |
| Izooktan, LO=100 | n-heptan, LO=0 |
Wartość liczby oktanowej dla n-heptanu wynosi 0, dla rozgałęzionego węglowodoru, jakim jest izooktan wynosi 100. Izooktan ma najkorzystniejsze parametry spalania.
Możliwe jest uzyskanie benzyny o określonej liczbie oktanowej przez dokładną, wielokrotną rektyfikację ropy naftowej, wiąże się to jednak z dużymi kosztami. Z tego względu typowa surowa benzyna, która została poddana standardowej rafinacji ma liczbę oktanową między 40 a 60. Liczbę oktanową uśrednia i powiększa proces krakingu, jednak również maksymalnie do poziomu ok 80-90.
Kraking
polega na inicjowaniu kontrolowanego rozkładu długich węglowodorów alifatycznych zawartych w ciężkich frakcjach otrzymywanych w procesie rafinacji ropy naftowej, na związki o krótszych łańcuchach węglowych, takich jakie występują w benzynie i oleju napędowym.
Reforming
W wysokiej temperaturze oraz pod działaniem odpowiednich katalizatorów następuje izomeryzacja prostych łańcuchów węglowodorowych do rozgałęzionych oraz odwodornienie prowadzące do cyklizacji i aromatyzacji — proces ten nazywamy reformingiem.
Współczesne silniki iskrowe stosowane w samochodach wymagają benzyny o liczbie oktanowej minimum 95, zaś produkcja paliwa o takiej liczbie wyłącznie w procesie rafinacji i krakingu jest ekonomicznie nieopłacalna.
Stosuje sie więc chemiczne dodatki do paliw, które zapobiegają zjawisku spalania stukowego (środki przeciwstukowe lub antydetonatory) i w sztuczny sposób podnoszą liczbę oktanową benzyny.
Tetraetyloołów
zwiększa liczbę oktanową z 80 do 100. Jest jednak silnie toksyczny, a spalanie benzyny, która go zawierała powodowało skażenie środowiska znacznymi ilościami ołowiu, z tego względu wycofano się z jego stosowania.
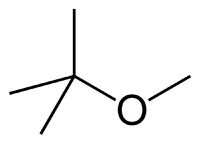
Najczęściej stosowanym środkiem przeciwstukowym w benzynach bezołowiowych jest eter tert-butylowo-metylowy (MTBE).
CYKLOALKANY
Łańcuchy węglowodorowe mogą zamykać się w pierścienie tworząc związki cykliczne.
Cykliczne alkany raczej nie występują w naturze, natomiast w wielu związkach naturalnych znajdują się alicykliczne ugrupowania.
Cyklopropan
Jest najprostszym przedstawicielem cykloalkanów.
Pochodne cyklopropanu występują m.in. w chryzantemach:
Izomeria cis-trans cykloalkanów
Dipodstawione cykloalkany niezależnie od wielkości pierścienia mogą występować w postaci dwóch izomerów cis lub trans. W izomerze cis oba podstawniki znajdują się po tej samej stronie pierścienia, a w trans po stronach przeciwnych.
Cyklobutan
W cząsteczce cyklobutanu kąt pomiędzy wiązaniami jest trochę mniejszy od 90º, równy jest 88º. Pierścień cyklobutanu nie jest płaski, ale wzajemne bardzo szybkie przemiany konformerów uśredniają jego budowę.

|

|
| Cyklobutan | Przemiany konformerów cyklobutanu |
Układ cyklobutanu możemy znaleźć w kwasie tłuszczowym występującym w bakteriach wykorzystywanych w procesie przemysłowego oczyszczania ścieków (proces anammox).
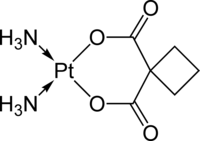
Również lek przeciwnowotworowy karboplatyna zawiera układ cyklobutanu. Działanie tego leku polega na utworzeniu krzyżowych wiązań między sąsiadującymi nićmi DNA oraz w obrębie tej samej nici (interkalacja). Tworzenie tych poprzecznych wiązań uniemożliwia replikację DNA i podział komórki.
Cyklopentan
W cyklopentanie kąt wewnętrzny pięcioboku foremnego (108º) ma wartość zbliżoną do wartości kąta tetraedrycznego, tak więc płaska cząsteczka cyklopentanu powinna być beznapięciowa. Jednak ciasno upakowane atomy w cząsteczce cyklopentanu odpychają się i lekko ją deformują.
|
|
| Schemat cyklopentanu | Struktura cyklopentanu |
Cykloheksan
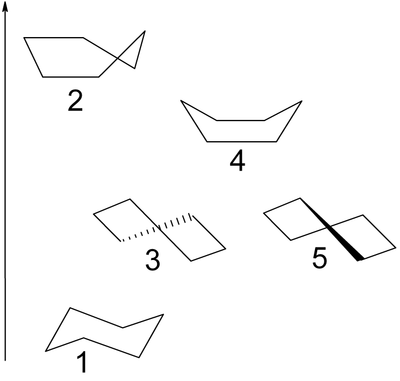
Jego pierścień nie jest płaski. Dzięki możliwości zachowania w części swobodnego obrotu wokół wiązań [math]\mathrm{C}-\mathrm{C}[/math] cząsteczka przyjmuje konformacje zapewniające kąt tetraedryczny pomiędzy wiązaniami poszczególnych atomów węgla. Takich konformacji może być bardzo dużo. Pośród nich wyróżnia się konformacje krańcowe: krzesłową, półkrzesłową, łódkową i skręconej łódki. Różnią się one trwałością. Najbardziej trwała (o najniższej energii) jest konformacja krzesłowa.
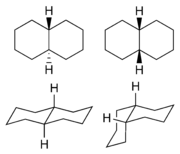
Cykloalkany dicykliczne i policykliczne
Dekalina (bicykliczny węglowodór)
Adamantan (tricykliczny węglowodór)
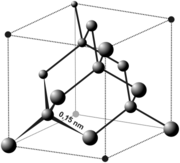
Diament
odmiana alotropowa węgla, składająca się wyłącznie z atomów węgla o hybrydyzacji sp3.
Kuban
syntetyczny węglowodór policykliczny
Układy cykliczne c.d.
Liczną grupę węglowodorów cyklicznych i policyklicznych stanowią związki zawierające pierścień aromatyczny.
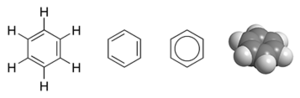
Benzen
([math]\mathrm{C}_6\mathrm{H}_6[/math]) to organiczny związek chemiczny z grupy arenów. Jest to najprostszy karbocykliczny, obojętny węglowodór aromatyczny.
Atomy węgla posiadają hybrydyzację [math]sp^2[/math]. Jego strukturę możemy przedstawić następująco:
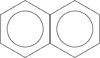
Naftalen
(naftalina, [math]\mathrm{C}_{10}\mathrm{H}_8[/math]) – organiczny związek chemiczny, najprostszy z możliwych policyklicznych węglowodorów aromatycznych o dwóch skondensowanych pierścieniach benzenowych.
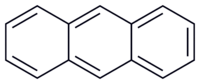
Antracen
([math]\mathrm{C}_{14}\mathrm{H}_{10}[/math]) – organiczny związek chemiczny, policykliczny węglowodór aromatyczny, trójcykliczny o trzech skondensowanych pierścieniach benzenowych.
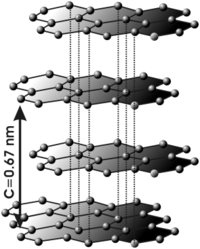
Grafit
jest odmianą alotropową węgla. Struktura grafitu składa się z warstw (grafeny), w których występują sprzężone, sześcioczłonowe aromatyczne układy cykliczne, podobne do benzenu.
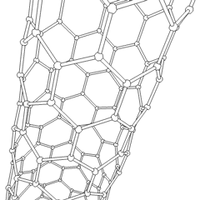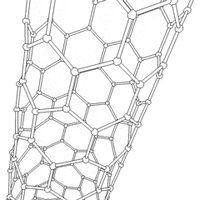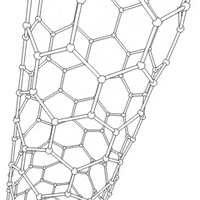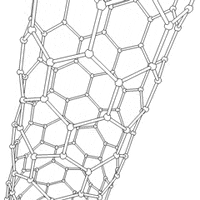
Nanorurki
struktury nadcząsteczkowe (supramolekularne), mające postać pustych w środku walców. Nanorurki węglowe zbudowane są ze zwiniętego grafenu (jednoatomowej warstwy grafitu).
Fulereny
(fullereny), cząsteczki składające się z parzystej liczby atomów węgla, tworzące zamkniętą, pustą w środku bryłę.
Powierzchnia fulerenów składa się układu sprzężonych pierścieni składających się z pięciu i sześciu atomów węgla. Najpopularniejszy fuleren, zawierający 60 atomów węgla (tzw. [math]\mathrm{C}_{60}[/math]) ma kształt dwudziestościanu ściętego, czyli wygląda dokładnie tak, jak piłka futbolowa.
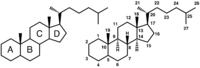
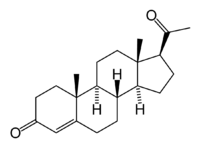
Steran
Kolejny bardzo ważny układ policykliczny to steran (cyklopentanoperhydrofenantren).
Układ steranu występuje w organicznych związkach chemicznych – steroidach. W zależności od rodzaju steroidu szkielet ten może być w różny sposób rozbudowany o dodatkowe atomy węgla, tworząc np. układ estranu, androstanu, pregnanu, cholanu i cholestanu. Do układów tych mogą być przyłączone rozmaite grupy funkcyjne zmieniające w szerokim zakresie ich aktywność biologiczną.
- Cholesterol
- Testosteron
- Estradiol
- Progesteron

|

|

|
|
| Cholesterol | Testosteron | Etradiol | Progesteron |
ALKENY
Należą do grupy tzw. węglowodorów nienasyconych i posiadają co najmniej jedno wiązanie podwójne, w którym atomy węgla mają hybrydyzację [math]sp^2[/math].
Nazwy alkenów są tworzone z nazw odpowiednich alkanów. Z nazwy alkanu posiadającego ten sam szkielet węglowy usuwa się końcówkę -an i dodaje końcówkę -en, przed którą umieszcza się lokant, wskazujący, przy którym atomie węgla występuje podwójne wiązanie.
Na przykład:

|

|
| Pentan | 1-penten |
Atomy węgla wiązania podwójnego w alkenie posiadają hybrydyzację [math]sp^2[/math], w związku z czym alkeny są płaskie. Wiązanie podwójne składa się z jednego wiązania [math]\sigma[/math] (sigma) i jednego wiązania [math]\pi[/math] (pi). Proszę zwrócić uwagę na różnicę w lokalizacji gęstości elektronowej w wiązaniach [math]\sigma[/math] i [math]\pi[/math]. Określa ona reaktywność alkenów.
Alkeny, pomimo takiego samego wzoru sumarycznego mogą różnić się budową, a ściślej — ułożeniem atomów w przestrzeni. Jest to rodzaj stereoizomerii zwanej izomerią geometryczną cis-trans. Z ułożeniem cis mamy do czynienia, gdy podstawniki znajdują sie po tej samej stronie wiązania podwójnego:

|

|
| cis-but-2-en | trans-but-2-en |
Izomer trans posiada podstawniki ulokowane po przeciwnej stronie wiązania podwójnego.
Możliwa jest również tzw. izomeria konstytucyjna, związana z położeniem wiązania podwójnego w łańcuchu. Na przykład dla butenu możemy narysowac kolejny izomer. Nie będzie to jednak stereoizomer but-2-enu, ale izomer różniący się od niego budową.
Izomerii konstytucyjnej nie należy zatem mylić z izomerią przestrzenną — stereoizomerią.
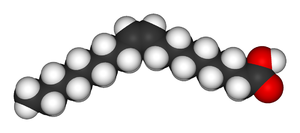
Nienasycone kwasy tłuszczowe występujące w naturze, np. kwas oleinowy są izomerami cis.

|
|
| kwas oleinowy struktura | kwas oleinowy wizualizacja |
Charakterystyczne reakcje alkenów
Reaktywność alkenów ma związek z łatwą dostępnością elektronów wiązania [math]\pi[/math] (które jest słabsze i łatwiej ulega rozerwaniu). Dominują zatem reakcje przyłączania do wiązania podwójnego (reakcje addycji):
- wodorowanie katalityczne
[math] \mathrm{C}_n\mathrm{H}_{2n-2} + 2\mathrm{H}_2\ \rightarrow\ \mathrm{C}_n\mathrm{H}_{2n+2} [/math]
Reakcja addycji wodoru do wiązania podwójnego wymaga obecności katalizatora. Reakcja ta wykorzystywana jest szeroko w chemii. W przemyśle stosuje się ją na wielką skalę w celu zwiększenia trwałości tłuszczów nienasyconych, zawierających kwasy tłuszczowe z przynajmniej jednym wiązaniem podwójnym, występujących głównie w olejach roślinnych (nasycanie tłuszczów nienasyconych do nasyconych).
- reakcja przyłączania cząsteczki bromu ([math]\mathrm{Br}_2[/math]) do wiązania podwójnego:
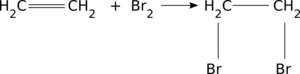
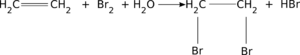
przyłączanie cząsteczki bromu do wiązania podwójnego Ciekawostką jest nieco odmienny chemizm tzw. odbarwiania wody bromowej (powyżej) - reakcja polimeryzacji
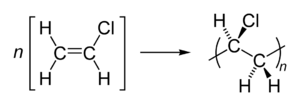
[math] n\ \mathrm{CH}_2=\mathrm{CH}_2\ \rightarrow [-\mathrm{CH}_2-\mathrm{CH}_2-]_n [/math] Polimery w zależności od masy i struktury posiadają inne właściwości, polietyleny niskocząsteczkowe są miękkie, z kolei rozgałęzienia zwiększają elastyczność. - Polipropylen (PP) występuje w trzech podstawowych typach strukturalnych, które różnią się położeniem grup — [math]\mathrm{CH}_3[/math] (metylowych) w przestrzeni względem swoich sąsiadów. W zależności od warunków polimeryzacji i rodzaju katalizatora, można otrzymywać następujące odmiany polimeru:
- PP ataktyczny (przypadkowy)
- PP izotaktyczny (uporządkowany) — najlepsze właściwości mechaniczne, można otrzymać go stosując katalizatory typu Zieglera-Natty
- PP syndiotaktyczny (naprzemienne położenie grup metylowych)
Polipropylen ataktyczny Polipropylen izotaktyczny Polipropylen syndiotaktyczny - Inne znane polimeryczne tworzywa sztuczne:
- Polichloroetylen (Polichlorek winylu - PCW)
- Polistyren
- Teflon
- reakcja przyłączenia reagentów o cząsteczkach niesymetrycznych
Jeżeli reakcja prowadzona jest w ciemności, bez dostępu tlenu i bez dodatku inicjatorów wolnych rodników, obowiązuje tzw. reguła Markownikowa — bardziej elektroujemna grupa przyłącza się zawsze do tego atomu węgla, przy którym jest mniej atomów wodoru, bądź — bardziej elektrododatnia grupa przyłącza się do tego atomu węgla, przy którym atomów wodoru jest więcej.
W przypadku propenu, grupa metylowa sąsiadująca z wiązaniem podwójnym jest grupą elektronodonorową, powoduje desymetryzację wiązania podwójnego (pojawia się moment dipolowy i wiązanie ulega przesunięciu), a jeden z atomów węgla zyskuje cząstkowy ładunek ujemny:
|

|
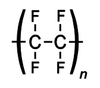
|
| PCW | Polistyren | Teflon |
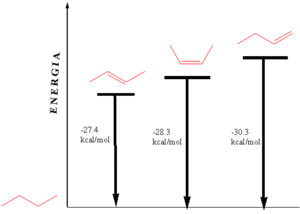
Energia wewnętrzna alkenów
Energię wewnętrzną alkenów mierzymy w reakcji ich całkowitego uwodornienia poprzez pomiar ciepła, jakie zostaje pochłonięte w tej reakcji.
Stereochemia związku ma wpływ na trwałość cząsteczki, spośród izomerów butenu najtrwalszy (ma najniższą energię wewnętrzną) jest trans-but-2-en.
Jeżeli w cząsteczce obecnych jest kilka wiązań podwójnych, to położenie tych wiązań ma wpływ na energię wewnętrzną cząsteczki.
Sprzężenie układu wiązań podwójnych sprzyja zatem obniżeniu energii wewnętrznej cząsteczki, czyli stabilizuje układ. Jeszcze większy wkład w stabilizację cząsteczki ma zjawisko aromatyczności.
DIENY SPRZĘŻONE
Węglowodory nienasycone, w których występują dwa wiązania podwójne rozdzielone jednym wiązaniem pojedynczym:
Najprostszym dienem sprzężonym jest buta-1,3-dien:
Dieny sprzężone są bardziej reaktywne od prostych alkenów, a mniej reaktywne od allenów (dienów skumulowanych).
Dieny sprzężone ulegają addycji do alkenów, dając jako produkt reakcji, pochodne cykloheksenu. Reakcję tę nazywamy reakcją cykloaddycji Dielsa-Aldera.
Sprzężone dieny, podobnie jak proste alkeny, ulegają reakcjom polimeryzacji.
Naturalnym polimerem izoprenu jest kauczuk naturalny. Wiązania podwójne w kauczuku naturalnym mają geometrię cis- (w nowszym systemie nomenklatury oznaczana jest ona jako Z-). Istnieje również naturalny analog kauczuku - gutaperka, w którym wiązania podwójne mają geometrię trans- (E-). Gutaperka jest twardsza, skóropodobna i bardziej łamliwa niż guma, znalazła zastosowanie w produkcji np. piłek golfowych.
Plik:Izopren kauczuk gutaperka.gif
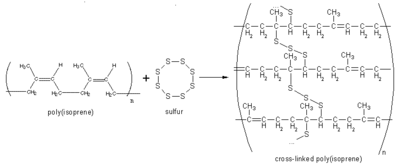
W praktyce, na drodze polimeryzacji otrzymuje się wiele syntetycznych rodzajów kauczuków. Są one materiałami miękkimi i dość lepkimi. Ich utwardzenie następuje w procesie wulkanizacji. Surowy polimer ogrzewa się z siarką, która powoduje usieciowanie polimeru (tworzą się mostki siarkowe pomiędzy łańcuchami polimerów). Roztwory kauczuku naturalnego zawierające substancje wulkanizujące stosuje się m.in. jako kleje.
WĘGLOWODORY AROMATYCZNE
Kryteria aromatyczności
- Cykliczny układ sprzężonych wiązań [math]\pi[/math].
- Możliwość przyjęcia płaskiej geometrii.
- Spełniona reguła Hückela: liczba elektronów [math]\pi[/math] cyklicznego układu sprzężonego daje się zapisać jako [math] 4n+2\ (n = 0, 1, 2, 3,\dots)[/math].

|

|

|
| benzen | naftalen | antracen |
Benzen
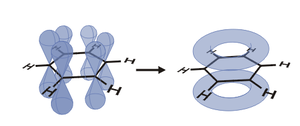
Wszystkie 6 atomów węgla oraz sześć orbitali p w benzenie są równocenne, co w konsekwencji prowadzi do wniosku, że 6 elektronów [math]\pi[/math] w benzenie jest całkowicie zdelokalizowanych w obrębie pierścienia.
Benzen jest hybrydą rezonansową dwóch równocennych struktur:
Cząsteczkę benzenu często rysuje się w postaci:
Kółko we wzorze reprezentuje sekstet elektronów zdelokalizowanych, nadający cząsteczce charakter aromatyczny. Aromatyczność daje molekule znaczną stabilizację energetyczną (o ile tylko cząsteczka jest płaska).
Warto zwrócić w tym miejscu uwagę na nieprawidłową (choć, niestety, często spotykaną) reprezentację cząsteczki naftalenu, która także jest aromatyczna:
Nieprawidłowość zapisu polega tu na umieszczeniu we wzorze dwóch kółek, symbolizujących sekstety elektronowe. Błędnie sugeruje to obecność dwóch takich sekstetów ([math]12e^-[/math]), podczas gdy naftalen posiada 10 elektronów [math]\pi[/math].
Benzen jest związkiem nienasyconym, jednak nie ulega reakcjom charakterystycznym dla alkenów (w wyniku reakcji z bromem otrzymujemy produkt substytucji, produkt addycji NIE powstaje). Warto zauważyć, iż reakcja z bromem nie zachodzi nawet w drastycznych warunkach, przy braku obecności specyficznego katalizatora — kwasu Lewisa. Może być nim np. halogenek żelaza lub glinu:
Substytucja elektrofilowa
Benzen i inne węglowodory aromatyczne ulegają reakcji substytucji elektrofilowej [math]\mathrm{S_E}[/math], w której elektrofil oddziałuje z elektronami pierścienia.
Do reakcji substytucji elektrofilowej należą, m.in.:
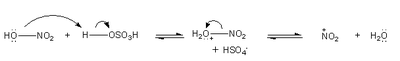
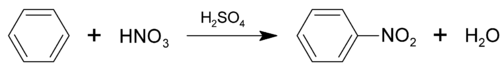
reakcja nitrowania
W mieszaninie nitrującej, która jest używana do nitrowania powstaje elektrofilowy kation nitroniowy ([math]\mathrm{NO}^{2+}[/math]).
W wyniku nitrowania benzenu otrzymujemy nitrobenzen.
reakcja halogenowania
W arenach pod wpływem halogenów ([math]\mathrm{Cl}_2[/math] i[math]\mathrm{Br}_2[/math] ) w obecności kwasów Lewisa (np. [math]\mathrm{FeX}_3[/math]) dochodzi do wymiany atomu wodoru na atom halogenu.
Wytwarzanie czynnika elektrofilowego:
[math] \mathrm{Br}-\mathrm{Br} \rightleftharpoons \mathrm{Br}_3\mathrm{Fe}^{\delta-}-\ -\ -\mathrm{Br}-\ -\ -\mathrm{Br}^{\delta+}\rightleftharpoons \mathrm{FeBr}_4^-+\mathrm{Br}^+ [/math]
Tworzenie nowego wiązania [math]\mathrm{C}-\mathrm{C}[/math] pomiędzy pierścieniem aromatycznym, a inną resztą organiczną, czyli reakcje alkilowania i acylowania arenów, katalizowane kwasem Lewisa (najczęściej chlorkiem glinu) nazywane są reakcjami Friedela-Craftsa (F-C).
reakcja alkilowania Friedla-Craftsa
Wytwarzanie czynnika elektrofilowego
[math] \mathrm{H}_3\mathrm{C-Cl}\rightleftharpoons \mathrm{Cl}_3\mathrm{Al}^{\delta-}-\ -\ -\mathrm{Cl}-\ -\ -\mathrm{C}^{\delta+}\mathrm{H}_3 \rightleftharpoons \mathrm{AlCl}_4^-+\mathrm{CH}_3^+ [/math]
reakcja acylowania Friedla-Craftsa
Wytwarzanie czynnika elektrofilowego
Reakcje [math]\mathrm{S_E}[/math] w podstawionych benzenach. Efekt kierujący i aktywujący podstawników
Reaktywność podstawionych arenów w reakcjach [math]\mathrm{S_E}[/math] zależy od właściwości podstawnika związanego z pierścieniem aromatycznym. Może on ułatwiać reakcję [math]\mathrm{S_E}[/math] (zwiększać szybkość reakcji poprzez zwiększenie gęstości elektronowej na pierścieniu aromatycznym. Nazywa się to uaktywnieniem pierścienia aromatycznego) lub ją utrudniać (obniżyć szybkość reakcji poprzez dezaktywację układu aromatycznego).
Podstawnik obecny w pierścieniu wpływa też na miejsce przyłączenia grupy biorącej udział w [math]\mathrm{S_E}[/math].
Podstawniki związane z pierścieniem aromatycznym z uwagi na wpływ, jaki wywierają na reakcje [math]\mathrm{S_E}[/math] dzielą się na trzy rodzaje:
- aktywujące: kierują one nowy podstawnik w położenie orto- lub para-. Należą do nich grupy elektronodonorowe (EDG), a więc [math]\mathrm{-OH}[/math], [math]\mathrm{-OR}[/math], [math]\mathrm{-N}\mathrm{H}_2[/math], [math]\mathrm{-NHR}[/math], [math]\mathrm{NR}_2[/math], —alkil.
- dezaktywujące: kierują nowy podstawnik w położenie meta-. Należą do nich grupy elektroakceptowowe (EWG): [math]-\mathrm{NO}_2[/math], [math]-\mathrm{COOH}[/math], [math]-\mathrm{COOR}[/math], [math]-\mathrm{CONR}_2[/math], [math]-\mathrm{CN}[/math], [math]-\mathrm{COR}[/math], [math]-\mathrm{COH}[/math] i [math]- ^+\mathrm{NR}_3[/math] ([math]\mathrm{R}[/math]: [math]\mathrm{H}[/math], alkil lub aryl).
- dezaktywujące, ale kierujące nowy podstawnik w położenie orto- lub para-. Należą do nich chlorowce.
Uwzględnienie efektów kierujących podstawników w pierścieniu aromatycznym ma ogromne znaczenie przy planowaniu kolejnych etapów syntezy, np.:
Jeśli substratem w naszej syntezie będzie toluen, to w wyniku reakcji nitrowania otrzymamy kolejno p-nitrotoluen (powstaje na zimno), potem (w wyniku dodania efektów kierujących grupy metylowej i grupy nitrowej) 2,4-dinitrotoluen (powstaje po delikatnym ogrzaniu mieszaniny reakcyjnej), a następnie 2,4,6-trinitrotoluen. Jeżeli natomiast związkiem wyjściowym w syntezie będzie nitrobenzen, to bez względu na to, czy najpierw poddamy go reakcji nitrowania czy alkilowania Friedla-Craftsa, to 2,4,6-trinitrotoluen nie powstanie.
Reakcje łańcuchów bocznych pierścienia:
- redukcja grupy nitrowej
- całkowita redukcja grupy karbonylowej
- utlenianie alkilowych pochodnych benzenu — zawsze prowadzi do kwasu benzoesowego
Antyaromatyczność
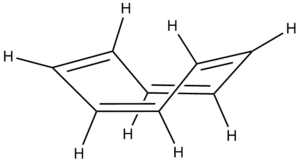
Nie wszystkie polialkeny, sprzężone i cykliczne uzyskują zwiększona trwałość wynikającą z efektu aromatyczności. Te, które spełniają regułę 4n elektronów [math]\pi[/math] (tzw. anty-Huckel’a), doznają silnej destabilizacji, gdy są płaskie. Ta destabilizacja nosi nazwę antyaromatyczności i jest zjawiskiem na tyle niekorzystnym, iż cząsteczka 1,3,5,7-cyklooktatetraenu przyjmuje wymuszoną konformację niepłaską, aby "uniknąć" antyaromatycznej destabilizacji. Ma ona właściwości typowego alkenu (na dodatek nietrwałego). Z kolei cząsteczka cyklobutadienu, której wielkość umożliwia wyłącznie płaską (prostokątną) konformację w stanie wolnym, jest niezwykle nietrwała. Destabilizacja antyaromatyczna wynosi tu -54,7 kcal/mol w stosunku do 1,3-butadienu, co jest sporo większą różnicą energii wewnętrznej od energii aromatycznej stabilizacji benzenu. Dodatkowo destabilizuje cząsteczkę naprężenie walencyjne (30.7kcal/mol) dając w rezultacie destabilizację -85,4kcal/mol. Nic zatem dziwnego, iż cząsteczkę bez dodatkowego utrwalenia kompleksowaniem można jedynie obserwować w matrycy np. argonowej. Co ważne, w cząsteczce cyklobutadienu wiązania podwójne i pojedyńcze są różnej długości, a cząsteczka skompleksowana atomem palladu może nawet przyjmować niepłaską konformację!

|

|
|
| Cyklobutadien | Cyklooktatetraen | 1,3,5,7-Cyklooktatetraen |
REAKCJE HALOALKANÓW
Charakterystyczną reakcją pochodnych węglowodorów zawierających zamiast jednego bądź kilku atomów wodoru atom chlorowca (halogen) jest substytucja nukleofilowa. Jest to reakcja podstawienia, w której czynnikiem atakującym jest nukleofil ([math]\mathrm{Nu}[/math] lub [math]\mathrm{Nu}_-[/math]).
Nukleofil, to cząsteczka lub grupa będąca donorem elektronów, „lubiąca” dodatnio naładowane jądra innych atomów. Często jest naładowana ujemnie.
Nukleofilem może być: cząsteczka wody, amoniaku, grupa hydroksylowa, czy też grupa nitrylowa. Rodzaj nukleofila determinuje szybkość reakcji substytucji nukleofilowej.
W zależności od mechanizmu reakcji wyróżniamy:
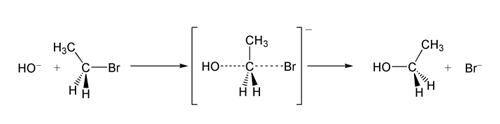
- substytucję nukleofilową jednocząsteczkową ([math]\mathrm{S_{N_1}}[/math]) — etap limitujący szybkość reakcji zależy od stężenia jednej substancji (substratu)
- substytucję nukleofilową dwucząsteczkową ([math]\mathrm{S_{N_2}}[/math]) — etap limitujący szybkość reakcji zależy od stężenia dwóch substancji (substratu i nukleofila).
Reakcje eliminacji towarzyszą substytucji.
Są to reakcje, w których następuje oderwanie od cząsteczki dwóch atomów lub grup funkcyjnych bez zastąpienia ich innymi podstawnikami.
Podstawowe typy reakcji eliminacji
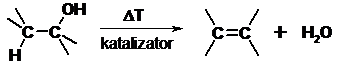
- Dehydrohalogenacja halogenków alkilów
- Dehydratacja alkoholi katalizowana kwasami
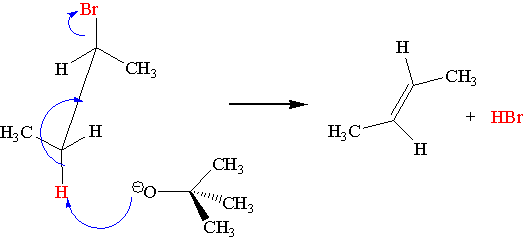
Orientacja w reakcjach eliminacji [math]\mathrm{E}_2[/math]
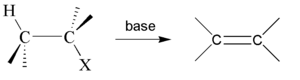
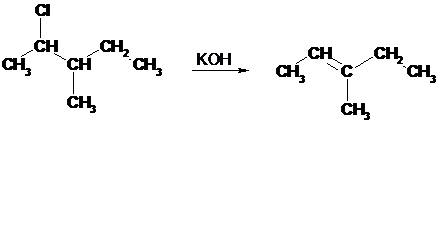
W większości reakcji dehydrohalogenacji orientacja ( położenie wiązania podwójnego w tworzącym się alkanie) jest zgodna z regułą Zajcewa.
Reguła Zajcewa
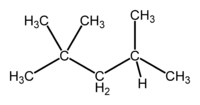
W reakcjach odszczepiania wody od alkoholi lub chlorowcowodorów od chlorowcoalkanów atom wodoru odszczepia się od tego z sąsiednich atomów węgla, który jest najuboższy w wodór.
Wykorzystując tę regułę można przewidywać produkty reakcji.
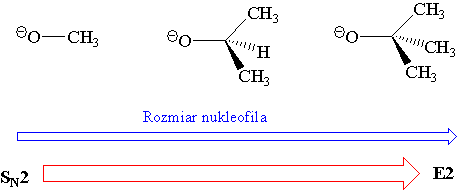
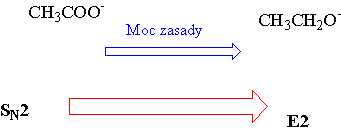
Wielkość nukleofila, jak również moc zasady mają wpływ na konkurencyjność [math]\mathrm{S_{N2}-E_2}[/math].