Elektroencefalografia/Przykłady zastosowań
Spis treści
- 1 Neurofeedback
- 1.1 Rodzaje neurofeedbacku
- 1.2 Historia powstania
- 1.3 Zastosowanie neurofeedbacku
- 1.4 Psychofizjologiczne podstawy działania biofeedbacku - Warunkowanie sprawcze oraz neuroplastyczność
- 1.5 Organizacja treningów
- 1.6 Artefakty
- 1.7 Opis przebiegu terapii
- 1.8 Wykorzystywane rozmieszczenia elektrod
- 1.9 Choroby leczone za pomocą terapii biofeedback oraz przykładowe protokoły
- 1.10 Nowe trendy
- 2 Interfejsy mózg-komputer
- 3 Badania snu
- 4 Epilepsja
- 5 Farmako-EEG
- 6 Literatura
Neurofeedback
W dzieciństwie uczymy się najpierw chodzić, później biegać, tańczyć. Ucząc się kontrolować ruchy własnych rąk i nóg, rozwijamy nasze zdolności motoryczne. Czy w takim razie analogicznie wiedza, którą posiadamy o tym, jak działa mózg, pozwala nam na kontrolowanie jego pracy? Odpowiedzią jest neurofeedback, który jest kompleksowym systemem treningowym, wprowadzającym zmiany na poziomie komórkowym mózgu (Demos 2005), (Swingle 2008). Zwiększa kontrolę nad funkcjonowaniem mózgu. Jest szczególnym rodzajem biofeedbacku, który zasadę swojego działania opiera na sprzężeniu zwrotnym sygnałów fizjologicznych takich jak tętno, temperatura ciała, elektryczna aktywność mięśni (EMG), skóry (EDA/GSR) etc. Biofeedback umożliwia sterowanie za pomocą bieżącego sprzężenia zwrotnego rejestrowanego sygnału, nieświadomymi i niezamierzonymi procesami fizjologicznymi. Neurofeedback (EEG Biofeedback) jest metodą wykorzystującą sygnały z Centralnego Systemu Nerwowego, jak np. aktywność fal mózgowych.
Rodzaje neurofeedbacku
EEG-biofeedback
LENS - Low Energy Neurofeedback System - wykorzystuje się tutaj bardzo słabe pole elektromagnetyczne, które modyfikuje działalnośc elektryczną mózgu. Dzięki temu mózg staje sie bardziej plastyczny i jego samoregulacja jest ułatwiona.
HEG - hemoencephalography - ten typ treningu modyfikuje przepływ krwi, zwiększając go w obszarach, gdzie występuje deficyt. Przepływ krwi odgrywa istotną rolę w funkcjonowaniu mózgu, gdyż krew zaopatruje tkanki w tlen i glukozę, które są niezbędne do ich prawidłowego funkcjonowania. Jest to podstawą do obserwacji prawidłowej aktywności rytmicznej mózgu. Zależność między zmniejszonym CBF a nieprawidłowościami w funkcjonowaniu mózgu została potwierdzona przez badania PET (Positron Emission Tomography) oraz SPECT (Single Photon Emission Computed Tomography) (Demos 2005). Podczas pracy neuronów występuje zwiększony przepływ krwi. Pacjent, wykorzystując mechanizm sprzężenia zwrotnego może modyfikować utleniwanie swojeg mózgu.
Historia powstania
Jeszcze w późnych latach ’50 minionego wieku ludzie sceptycznie odnosili się do pomysłów świadomego kontrolowania ANS, jednakże w przeciągu dekady udowodniono, że regulowanie sygnałów elektrycznych w korze mózgowej i poszczególnych mięśniach jest możliwe. Biofeedback jest metodą treningu, która powstała dla potrzeb NASA w latach sześćdziesiątych XX wieku. Miała ona pomóc astronautom w radzeniu sobie z powierzanymi im zadaniami podczas lotów kosmicznych w warunkach silnego stresu. O jej szybkim rozpowszechnieniu zadecydował korzystny ku temu profil zainteresowań panujących w Ameryce lat sześćdziesiatych i siedemdziesiątych. Bardzo modne były wówczas tematy stanów świadomości oraz hipnozy. Obserwuje się również silne dążenie do poznania kultur Dalekiego Wschodu oraz ich oddziaływanie przez zwrot w kierunku jogi, relaksacji i medytacji. Trzecim komponentem uzupełniającym ten obraz jest zainteresowanie psychodelicznymi narkotykami wpywającymi na świadomość. Poza tymi trednami obecnymi w kulturze amerykańskiej pod koniec lat sześćdziesiątych opublikowane zostały dwa artykuły, które w bardzo obiecujący sposób rokowały o terapii biofeedback. Pierwszy, w Science w 1969 roku, był autorstwa N. Millera. W swoich eksperymentach na zwierzętach dowodził on, iż można kształtować wolicjonalnie odpowiedź autonimicznego układu nerwowego bez udziału mięśni poprzecznie prążkowanych (Miller, 1969, za: Roberts, 1985). Drugi artykuł ukazał się w tym samym roku co poprzedni i odbił się dużym echem wśród klinicystów, mimo, iż nie był on pracą eksperymentalną. Dotyczył on wolicjonalnej kontroli fali alfa oraz związku między jej wystąpieniem a świadomością (Kamiya, 1969, za: Roberts, 1985). Nigdy nie udało się zreplikować żadnego z tych badań, aby uzyskać wyniki przedstawiane przez badaczy. Amatorów nowej metody zrzeszało, założone w 1969 roku, Biofeedback Research Society, które za cel stawiało sobie prowadzenie badań nad zastosowaniem tej metody. Zarówno sprzyjające warunki socjokulturowe jak i publikowane badania stworzyły bardzo podatny grunt do rozpowszechnienia się nowej metody, która miała szansę zapewnić wgląd w nieświadomość i dać kontrolę nad procesami, które dotychczas były uznawane za niemodyfikowalne wolicjonalnie przez człowieka.
Zastosowanie neurofeedbacku
Neurofeedback polega na świadomej obserwacji zmian zachodzących w aktywności naszego mózgu i zamianie nieprawidłowego rytmu na pożądany. Oscylacje fal, czyli ciągłe zmiany amplitudy określonych pasm częstotliwości, są rejestrowane za pomocą EEG podłączonego do komputera. Informacja zwrotna, jaką otrzymuje pacjent o aktywności swoich fal mózgowych, wyświetlana jest na monitorze obserwowanym przez pacjenta. Jego zadaniem jest zmiana aktywności fal mózgowych podczas obserwowania bieżącej rejestracji sygnału EEG. Parametry treningu ustala terapeuta kontrolujący przebieg całego treningu. By ułatwić pacjentom zadanie, podczas terapii jako informacje zwrotną wykorzystuje się aplikacje graficzne (gry komputerowe o bardzo uproszczonej formie) sterowane, zamiast joystickiem, klawiaturą, czy myszką, sygnałem EEG rejestrowanym przez komputer. Pacjent, za pomocą interfejsu graficznego ma za zadanie sprawić, by twarz widoczna na ekranie uśmiechnęła się lub samochód, którym steruje jechał szybciej. Prawidłowo wykonane zadanie polega na wygaszeniu niepożądanych oraz wzmocnieniu pożądanych częstotliwości fal. Wielokrotne powtarzanie treningów ma na celu wprowadzenie stałych zmian w aktywności mózgu, świadomej kontroli tych zmian oraz wykorzystywania tych umiejętności w życiu codziennym.
Początkowo, trening neurofeedback przeznaczony był dla ludzi zdrowych, chcących poprawić swoją sprawność intelektualną oraz umiejętność kontrolowania własnego stanu psycho-fizycznego. Skupiano się na nauce kontrolowania emocji i stresu oraz poprawie samooceny, jak również umiejętności koncentracji. Skuteczność metody sprawiła, że terapię neurofeedback zaczęto stosować u ludzi cierpiących z powodu zaburzeń, takich jak: epilepsja, bóle głowy, problemy z koncentracją, zaburzenia nastroju, zaburzenia odżywiania (anoreksja, bulimia), nerwice, parkinson, schizofrenia, zaburzenia snu, po urazach głowy, po udarach mózgu oraz wiele innych.
Atrakcyjność formy pozwoliła na stosowanie terapii u dzieci z dysfunkcjami rozwojowymi, np: zaburzenia rozwoju psychomotorycznego wieku dziecięcego, ADHD, czy zaburzenia mowy. Prawidłowo przeprowadzony trening nie powoduje efektów ubocznych, jak również daje możliwość ciągłej rejestracji mierzalnej poprawy stanu pacjenta, możliwej do zaobserwowania po kilku treningach (Demos 2005),(Robbins 2000).
Psychofizjologiczne podstawy działania biofeedbacku - Warunkowanie sprawcze oraz neuroplastyczność
Terapia neurofeedback to metoda usprawniania działania OUN (ośrodkowego układu nerwowego) poprzez tworzenie w mózgu nowych połączeń synaptycznych oraz osłabiania niepożądanych, już istniejących. Za działanie terapii biofeedback od strony psychofizjologicznej odpowiadają dwa zjawiska. Pierwsze, psychologiczne, to warunkowanie sprawcze (instrumentalne), drugie-neurofizjologiczne - neuroplastyczność układu nerwowego. Warunkowanie sprawcze niejako jest tutaj przyczyną zajścia procesów neuroplastyczności, a co za tym idzie uzyskania pożądanego efektu terapii.
Warunkowanie sprawcze: Proces ten nazywany jest również warunkowaniem drugiego typu lub warunkowaniem instrumentalnym. Ważnym elementem jest tutaj istnienie bodźca warunkowego, który wymaga wolicjonalnego wykonania danej reakcji przez organizm. W tym przypadku jest sposób generowania pożądanych fal. Wykonanie reakcji warunkowej, tj. zdobycie punktów w grze co jest pochodną generowania pożądanych fal mózgowych, powoduje zaspokojenie bodźca bezwarunkowanego. Badania nad warunkowaniem instrumentalnym leżały u podstaw założeń, na których opiera się neurofeedback (Gruzelier, Egner, 2005). Eksperymenty przeprowadzane przez Stermana na kotach polegały na prostym schemacie: aby dostać się do mięsa głodny kot musiał nacisnąć dźwignię. Następnie zadanie skomplikowano, przez konieczność rozpoznania przez zwierzęta zestawu błysków i dźwięków. Po wielu próbach koty ogniskowały uwagę na błyskach wytwarzając w korze sensomotorycznej rytm ok. 14 Hz (nazwany rytmem sensomotorycznym - SMR). Po treningu koty same generowały ten rytm będąc głodnymi. W ten sposób potwierdzono zależność, która leży u podstaw mechanizmu biofeedbacku. W porównaniu do normalnego warunkowania instrumentalnego, pacjent ma tutaj utrudnione zadanie, ponieważ rezultat jest niewidoczny i dużo bardziej abstrakcyjny. Pacjenci zmuszeni są w tej sytuacji wykorzystywać metodę prób i błędów, a informację o efektach dostają w formie symbolicznych punktów. Dlatego, w tym wypadku, kluczowe jest jasne rozumienie, za co przyznawana jest nagroda oraz motywacja i pozytywne nastawienie pacjenta.
Neuroplastyczność: U podstaw działania biofeedbacku leży funkcjonalna i anatomiczna plastyczność układu nerwowego. Plastyczność układu nerwowego zachodzi od poziomu najniższego, synaptycznego, między konkretnymi neuronami, przez zmiany w obrębie coraz większych struktur. Najprostszą zasadą tłumaczącą podstawowy mechanizm powstawania zmian plastycznych jest reguła Hebba. Mówi ona, że “jeśli neuron A w sposób częsty i powtarzalny powoduje pobudzenie i powstanie potencjału czynnościowego w neuronie B, nastąpią procesy wzrostowe lub metaboliczne w obu komórkach, tak że skuteczność pobudzenia neuronu B przez neuron A będzie zwiększona” (Hebb 1949). Na poziomie komórkowym w sytuacji, gdy dane połączenie neuronalne jest wykorzystywane częściej niż inne stanie się ono trwalsze, jego waga wzrośnie, przez co pobudzenie będzie następować szybciej. Zależność ta tłumaczy występowanie zjawiska LTP (long-term potentation, długotrwałe wzmocnienie synaptyczne). Występuje ono w sytuacji długotrwałego pobudzania synapsy między dwoma neuronami, w wyniku czego, po pewnym czasie odpowiedź pobudzanego neuronu na taki sam bodziec jest dużo silniejsza niż na początku. Cechą LTP jest szybka indukcja oraz długi czas trwania. Odwrotnym procesem do LTP jest LTD (long-term depression, długotrwałe osłabienie synaptyczne). Następuje wówczas spadek efektywności synapsy wywołany przez niedostateczną jej stymulacje. Obydwa wyżej opisane procesy występują w wielu rejonach mózgu i przypisywane im są m.in. procesy uczenia się, pamięci i redukcji zbędnej informacji. Zmiany plastyczne mają również swoje odbicie w morfologii synaps i neuronów. Wzmocnienie połączenia pomiędzy neuronami wiąże się ze wzrostem liczby synaps pomiędzy nimi i/lub silniejszą odpowiedzią pobudzanej synapsy (zmiana wagi synaptycznej). Wzmocnienie synaptyczne może wynikać z różnych procesów. Może mieć podłoże biochemiczne: przez zwiększenie wydzielania neurotransmitera, zmianę liczby receptorów na synapsie, wolniejsze usuwanie neurotransmitera ze szczeliny synaptycznej, uaktywnienie działania milczących (nieaktywnych) synaps. Na poziomie samej synapsy - przez zmianę właściwości wewnętrznych błony i zmianę jej pobudliwości, m.in. przez dodanie dodatkowych kanałów jonowych. Zmiana wagi synaptycznej może również nastąpić przez zmianę położenia jej na neuronie, np. połączenie aksonalne są dużo bardziej stabilne niż synapsy na kolcach dendrytycznych. W końcu zmiana odpowiedz synapsy może być uzyskana przez zmianę jej wielkości i kształtu, co usprawnia jej działanie. Plastyczność neuronalna jest przedmiotem zainteresowania badaczy i na chwile obecną nie sposób orzec, jakie czynniki decydują o występowaniu konkretnej zmiany pomiędzy synapsami. Stwierdzono, że procesy takie zachodzą na poziomie komórkowym i leżą u podłoża plastycznych zmian zachodzących w naszym układzie nerwowym, m.in podczas uczenia się. Dlatego szukając wyjaśnienia działania neurofeedbacku od strony fizjologicznej, zakłada się, że jest on związany z występowaniem procesów plastyczności synaptycznej. Neurofeedback to trening mózgu, więc aby można było zaobserwować poprawę w jego funkcjonowaniu, należy wyznaczyć pacjentowi zadanie wymagające pewnego wysiłku. W tym celu ustala się tak zwany „próg”, który określa poziom trudności wykonywanego zadania. Próg ten jest modyfikowany w czasie terapii, w zależności od postępów pacjenta. Warunkiem koniecznym, by trening przyniósł efekt, jest wprowadzenie elementu nagrody, która przyznawana jest w odpowiednim czasie – zawsze wtedy, gdy pacjent osiągnie pożądaną aktywność mózgu w trenowanym obszarze. Nagrodą tą są punkty przyznawane w czasie gry. Zmniejszanie amplitudy wybranych pasm częstości jest osiągane poprzez obniżanie progu. Zadaniem pacjenta, w takim wypadku, jest zmniejszenie amplitudy tak, by była ona mniejsza niż wartość progowa. Zwiększanie amplitudy jest osiągane poprzez podwyższenie progu na około 2/3 średniej wartości rejestrowanych amplitud wzmacnianego parametru. Pacjenci są nagradzani, gdy osiągnięta przez nich wartość amplitudy jest wyższa, niż wartość progowa, którą ustawia się 5-10 uV powyżej średnich wartości amplitud hamowanego parametru. Warto jednak zaznaczyć, że zdarza się, że nie jest to jedynym celem terapii - często zadaniem terapeuty jest przeprowadzenie treningu w taki sposób, aby uzyskać odpowiednie proporcje między parametrem hamowanym a wzmacnianym. W aparaturze EEG DigiTrack Biofeedback zastosowano w celu ułatwienia wyboru progu kolory. W przypadku wzmacniania parametru, im pod progiem więcej koloru (np. czerwonego, zielonego, etc), a mniej szarego, tym łatwiejsze zadanie przed pacjentem. W przypadku hamowania parametru, jest odwrotnie - im pod progiem więcej szarego, tym łatwiej pacjentowi osiągnąć pożądane parametry.
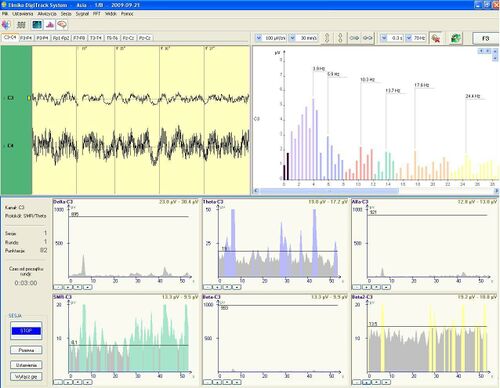
Organizacja treningów
Podczas treningu wymagamy od pacjenta skupienia i zaangażowania, dlatego należy zapewnić mu odpowiednie warunki. Trening powinien być przeprowadzany w pokoju wyciszonym, gdzie wraz z pacjentem przebywa jedynie terapeuta (oraz opiekun w przypadku takiej konieczności). Nie zaleca się używania oświetlenia typu „świetlówka”, jednakże nie ma rygorystycznych wskazań dotyczących oświetlenia pokoju terapeutycznego — w zależności od dysfunkcji, pacjenci różnie reagują na intensywność światła. Aby poprawić pacjentom (np. z ADHD) warunki pracy, zaleca się, by wystrój pokoju był oszczędny (nie rozpraszał uwagi pacjenta), lecz sprzyjający relaksowi. Dopuszcza się stosowanie muzyki relaksacyjnej w tle. W celu wyeliminowania artefaktów ruchowych i mięśniowych, istotne jest by fotel, na którym siedzi pacjent był stabilny, z zagłówkiem oraz bez możliwości „bujania się” oraz żeby nogi spoczywały wygodnie i nieruchomo. Należy pamiętać, że kluczowe jest zapewnienie pacjentowi komfortowej pozycji sprzyjającej relaksowi i rozluźnieniu. Fotel umiejscawia się na wprost monitora, na którym wyświetlana jest gra, w odległości 1-1,5 m. Głowica aparatury medycznej nie powinna znajdować się bliżej, niż 1,5 m od monitora. Drugi monitor, na którym wyświetlane są informacje o przebiegu terapii, powinien być ustawiony tak, by pacjent nie widział co się na nim znajduje, gdyż mogłoby to spowodować dekoncentrację. Należy pamiętać, by nie ustawiać aparatury w pobliżu urządzeń emitujących pole elektromagnetyczne, gdyż może to zakłócić pracę aparatury, jak również wpłynąć na czynność bioelektryczną mózgu. Dodatkowe zalecenia można uzyskać u producentów aparatury medycznej. Istotne jest, by trening był prowadzony systematycznie, o tej samej godzinie, nie częściej niż raz dziennie (konieczny sen między treningami), ale nie rzadziej niż dwa razy w tygodniu. Czas przeznaczony na jeden trening jest sprawą indywidualną (Demos 2005). Przy jego ustalaniu należy wziąć pod uwagę fakt, że podczas sesji treningowej pacjenta może bardzo zmęczyć wykonywanie konkretnego zadania, na przykład koncentrowanie uwagi. Postępy, jakie wykonuje pacjent podczas gry obserwuje się po pierwszych treningach, jednakże konieczne jest powtarzanie treningów w celu utrwalenia zmian. Dlatego też terapia u większości pacjentów składa się zazwyczaj z 20-60 treningów, choć w niektórych przypadkach liczba to może być większa (Demos 2005). U osób zdrowych, poprawę funkcjonowania odnotowuje się po 20 treningach. U osób z zaburzeniami wymagane jest minimum 40-60 treningów. Terapia neurofeedback wymaga systematyczności i cierpliwości. Częstym zjawiskiem jest załamanie występujące, w zależności od cech indywidualnych, raz lub kilka razy w czasie terapii. Zdarza się, że powtarzanie się tego zjawiska jest powodem rezygnacji pacjentów z kontynuowania terapii.
Artefakty
Podczas wykonywania badania EEG należy być świadomym wpływu niepożądanych czynników na zapis czynności bioelektrycznej mózgu. Przekłamania rejestrowane jako fale wolne mogą mieć pochodzenie ruchowe (np. mruganie). Jako zakłócenie pasm o wysokiej częstotliwości mogą być odczytane artefakty mięśniowe. Ocena przewagi amplitudy w jednej z półkul może być zafałszowana przez różną grubość kości czaszki po obu jej stronach. Warto pamiętać, że skóra, kości czaszki i płyn mózgowo-rdzeniowy tworzą filtr dolnoprzepustowy, co również zmienia postać rejestrowanego sygnału. Na czynność bioelektryczną mózgu wpływają leki, używki oraz dodatki do żywności (Budzynski et al., 2009). W zależności od ich składu chemicznego, modyfikują one różnorodnie sygnał EEG. Na przykład potwierdzono wpływ na czynność bioelektryczną mózgu takich substancji jak gabapentin, karbamazepina (*), okskarbazepina, fenytoina, czy nootropil będących składnikami wielu leków. Pamiętać jednak należy, że znaczący wpływ na rejestrowany sygnał EEG mają również tak powszechne substancje jak witaminy z grupy B oraz alkohol, kofeina, czy nikotyna. Warto zaznaczyć, że różnice międzyosobnicze EEG bywają większe, niż zmiany spowodowane spożyciem niektórych wyżej wymienionych substancji. Niemniej zmiany te mogą odgrywać kluczową rolę przy przeprowadzaniu treningu - ustalaniu progu, uzyskiwaniu pożądanych wzorców fal mózgowych oraz określaniu postępów terapii. Ustawienia sesji treningowej (DigiTrack) dają możliwość częściowego wykluczenia artefaktów, poprzez dyskryminowanie sygnałów o wyższej amplitudzie niż zadana. Jednakże, z powodu różnej postaci występujących zakłóceń, terapeuta powinien być świadomy możliwych przekłamań. Zapewnienie odpowiednich warunków treningowych może znacząco wpłynąć na ograniczenie artefaktów występujących w rejestrowanym sygnale.
Opis przebiegu terapii
Osoba decydująca się na terapię metodą biofeedback, przed rozpoczęciem właściwych treningów musi odbyć rozmowę z terapeutą oraz badanie diagnostyczne. Pierwszym krokiem do rozpoczęcia terapii jest przeprowadzenie przez terapeutę wywiadu z pacjentem. Podczas jego trwania terapeuta powinien dowiedzieć się o dolegliwości pacjenta, zażywane leki, jaka jest jego historia choroby oraz oczekiwania względem terapii. Jest to moment, aby dokładniej przybliżyć pacjentowi szczegóły terapii oraz ogólnie przedstawić, jakich efektów i po jakim czasie może się spodziewać. W zależności od choroby niektórzy terapeuci wykonują badania neuropsychologiczne lub testy psychologiczne w celu rozwiania wątpliwości co do przyszłej diagnozy. Podczas wywiadu ważne jest dobre nawiązanie kontaktu pomiędzy terapeuta a pacjentem. Gwarantuje to bardziej owocną współpracę oraz lepsze rezultaty terapii. Kolejnym niezbędnym krokiem przed rozpoczęciem terapii jest odbycie przez pacjenta badania diagnostycznego. Konieczność ta wynika z bardzo indywidualnego charakteru zmian w pracy mózgu u poszczególnych osób. Nie można trafnie dobrać rodzaju treningu tylko na podstawie obserwacji zachowania pacjenta oraz przedstawionego przez niego opisu dolegliwości. W zależności od terapeuty i sprzętu jaki posiada można wykonać pomiar sygnału przy użyciu tradycyjnego czepka do EEG lub wykorzystać do tego elektrody głowicy do neurofeedbacku. Sygnał zbierany jest wtedy obustronnie wzdłuż osi środkowej głowy z kolejnych punktów na czaszce, referencją jest elektroda umieszczona na płatku ucha. Aby trafnie zdiagnozować nieprawidłowości pracy określonego obszaru mózgu z każdego punktu sygnał zbierany jest w trzech warunkach: 1. osoba siedzi z otwartymi oczami 2. osoba siedzi z zamkniętymi oczami 3. osoba dostaje zadanie do wykonania, powinna się skupić na jakimś przedmiocie lub przeczytać zadany tekst. Całe badanie diagnostyczne przeprowadza się przy wyłączonym monitorze i trwa ono około 90 minut (Hammond, 2006). Zebrany sygnał jest obrabiany przez program, usuwane są artefakty. Końcowym efektem jest wynik liczbowy, który można przyrównać do danych zgromadzonych w bazie, odpowiednich do wieku badanego oraz na tej podstawie diagnozować o zaburzeniu. W niektórych przypadkach klinicyści analizują cały zapis EEG nie tylko dane liczbowe uzyskane z obliczeń programu.
Na kolejnym spotkaniu terapeuta przedstawia diagnozę, wybrany protokół (rodzaj treningu) oraz plan prowadzenia terapii, m.in. ilość sesji koniecznych do uzyskania poprawy oraz plan rozmieszczenia ich w czasie. Konieczne jest, aby między treningami był 24 godzinny odstęp oraz sen. Zaleca się również, żeby nie odbywały się rzadziej niż dwa razy w tygodniu. Ilość sesji uzależniona jest tutaj od zaburzenia, waha się od 15-20 w przypadku lęku i bezsenności do 40-50 przy leczeniu ADHD (Hammond, 2006). W zależności od podłoża zaburzenia często zdarza się, że koniecznym uzupełnieniem dla terapii biofeedback jest uczęszczanie na terapię psychologiczną. W przypadku, gdy zaburzenie ma korzenie fizjologiczne terapia biofeedback powinna przynieść pożądane skutki i jej rezultaty powinny być trwałe. W sytuacji gdy chorobę wywołują problemy psychiczne sam biofeedback będzie leczeniem objawowym i najprawdopodobniej pacjent nie uzyska trwałej poprawy, lecz po pewnym czasie może spodziewać się nawrotu dolegliwości. Dlatego bardzo ważne jest umiejętne przeprowadzenie wywiadu z pacjentem, nawiązanie z nim dobrego kontaktu oraz rzetelne przeanalizowanie zebranego przez terapeutę materiału i trafne zdiagnozowanie choroby. Terapia neurobiofeedback jest całkowicie bezbolesna i nie powinna powodować żadnych efektów ubocznych. Czasami zdarza się, że pacjenci mają poczucie zmęczenia, podniecenia lub rozdrażnienia. Niektórzy pacjenci uskarżają się początkowo na bóle głowy i problemy z zaśnięciem. Wymienione objawy mijają w krótkim czasie po sesji treningowej. W przypadku wystąpienia dolegliwości terapeuta powinien zmodyfikować protokół terapii (Hammond, 2006).
Wykorzystywane rozmieszczenia elektrod
Urządzenie do neurofeedbacku składa się ze wzmacniacza sygnałów EEG wraz z odpowiednim oprogramowaniem. Do podłączania elektrod stosuje się międzynarodowy system 10-20, z którego wykorzystuje się jedynie zapis jednokanałowy lub dwukanałowy. Dwukanałowe EEG jest bardziej wszechstronną metodą zbierania sygnału z czaszki, niż pomiar jednokanałowy. Umożliwia zarówno porównywanie sygnałów z różnych obszarów mózgu, jak również ich jednoczesne trenowanie. Jest to duża zaleta, gdyż różne obszary mózgu nie funkcjonują niezależnie — tworzą system. W dwukanałowym EEG, każdy kanał posiada dwie elektrody aktywne, natomiast elektroda uziemiająca jest wspólna dla obu kanałów.
Choroby leczone za pomocą terapii biofeedback oraz przykładowe protokoły
Biofeedback jest stosowany zarówno do leczenia chorób i zaburzeń, jak i do polepszania umiejętności uczenia się, koncentracji, relaksacji itp. Warto zwrócić tutaj uwagę, że podłożem niektórych chorób jest złe funkcjonowanie pracy mózgu i co za tym idzie, zaburzony wzór jego aktywności. W takich przypadkach zastosowanie biofeedbacku zdaje się usuwać przyczyny choroby. W wielu przypadkach, gdy zaburzona aktywność jest wynikiem innych czynników, np. psychicznych, biofeedback może mieć jedynie doraźne, krótkoterminowe zastosowanie.
ZESPÓŁ NADPOBUDLIWOŚCI PSYCHORUCHOWEJ (ADHD)
U osób cierpiących na ADHD stwierdzono zaburzenia aktywności mózgu w postaci zredukowanej czynności 'beta' i pasma SMR oraz podwyższonej częstości 'theta'. Badania Manna (za: Gruzelier i Egner, 2005) pokazują, że podczas zadań wymagających utrzymywania skupionej uwagi u dzieci z ADHD następuje wzrost thety w czołowych centralnych obszarach wraz ze spadkiem bety w tylnych obszarach skroniowych. Pokazuje to, iż obszary decydujące o wykonaniu zadania - płaty czołowe - wykazują aktywność, która pojawia się u zdrowego człowieka podczas odpoczynku. Niski poziom bety u dzieci z ADHD może mieć związek z brakiem umiejętności skupienia uwagi. Podczas wykonywania zadań wymagających wzrokowo-przestrzennej uwagi zauważono u badanych wzrost aktywności w paśmie beta. Pojawiał się on tylko w przypadku koncentrowania się na jednym bodźcu. W chwili gdy konieczna była podzielność uwagi następował spadek aktywności w tym pasmie (za: Gruzelier, J, Egner, T., 2005). Jak wynika z badań Lubara (za: Gruzelier i Egner, 2005) rytm SMR wygasza lub stabilizuje aktywność motoryczną bez spadku uwagi. Ten typ treningu najczęściej łączony jest ze zwiększaniem wyższych komponentów bety1 (15-18 Hz) z wygaszaniem niskich częstości thety (4-7 Hz), które związane są z początkowymi stadiami snu i powodują senność oraz rozkojarzenie. Główne postulaty postępowania przy dobieraniu treningu neurofeedback pochodzą z badań Lubara, pioniera w stosowaniu tego typu terapii w stosunku do osób z ADHD. Podstawowe założenia to: obniżenie poziomu thety, wzbudzenie wyższych pasm- SMR i bety - oraz hamowanie wysokich częstotliwości, które są często zakłócane przez artefakty z mięśni. Trening odbywał się przy użyciu elektrody Cz, ponieważ jej umiejscowienie pozwala na rejestracje sygnału zarówno z kory sensomotorycznej jak i czołowej. ADHD nie jest zaburzeniem jednorodnym i wśród chorych można wyróżnić różne rodzaje objawów. Jedną z klasyfikacji zaproponował Clarke (za: Gruzelier i Egner, 2005). Wyróżnił on trzy typy, w jakich może przejawiać się syndrom ADHD: typ ADHDin - inattentive - przeważa tutaj przede wszystkim brak umiejętności skupienia uwagi, typ ADHDhyp - hyperactive - z dominującą nadpobudliwością ruchową, oraz trzeci - ADHDcom - combined - typ mieszany. W obrębie tych trzech typów prowadzone były badania aktywności mózgu w poszczególnych pasmach. Okazało się, że największe różnice w stosunku do osoby zdrowej ujawniły się w typie ADHDcom, gdzie był wyższy poziom delty i thety oraz niższy poziom bety w rejonach czołowych i centralnych. Najbliższy grupie kontrolnej był typ ADHDin. Te wyniki wskazują, iż nie jest możliwe stosowanie jednego typu terapii u grupy chorych na ADHD bez wcześniejszego przeprowadzenie dokładnych badań diagnostycznych i sklasyfikowania z jakim dokładnie zaburzeniem pracy mózgu mamy do czynienia. Ostatnie badania Gruzeliera i Egnera (2005) pokazują, że różne protokoły okazują się skuteczne w stosunku do polepszenia umiejętności skupienia uwagi w zależności od rodzaju popełnianych błędów. Błędy w zadaniach u osób badanych mogły wynikać z nieuwagi lub impulsywności. Trening SMR był skuteczny tylko u osób popełniających błędy przez impulsywną odpowiedź i skutkował zmniejszeniem ich ilości. Możliwe, iż poprawa ta była związana z polepszeniem hamowania odpowiedzi. Trening beta1 przyniósł natomiast odwrotne skutki: ilość błędów zwiększyła się i skrócił się czas reakcji. Wyniki te pozawalają przypuszczać, że dla typu ADHDhyp skuteczny może okazać się protokół SMR, a dla grupy ADHD protokół beta1. Aby odpowiedzieć na to pytanie konieczne jest przeprowadzenie dalszych badań.
ZABURZENIE OBSESYJNO-KOMPULSYWNE (OCD)
Przyczynę tego zaburzenia upatruje się w hiperaktywności neuronów wchodzących w skład połączeń pomiędzy boczną korą przedczołową, jądrem ogoniastym (Caudate Nucleus) a korą obręczy (Cingulate). Aktywność kory przedczołowej wzrasta, kiedy mamy poczucie nieprawidłowości stanu rzeczy, stwierdzamy, że “coś jest nie tak jak powinno”. Jądro ogoniaste zawiązane jest z zaspokajaniem potrzeb i popędów (np. mycia) i reakcjami automatycznymi. Z kolei kora obręczy odpowiada za skupienie uwagi w sytuacjach poczucia niepewności oraz za świadome przeżywanie emocji. Osoba z zaburzeniem obsesyjno-kompulsywnym wykazuje bardzo silną aktywację kory przedczołowej oraz jądra ogoniastego w momencie myślenia o zjawisku zawiązanym z kompulsją (czynność wykonywana w celu zapobiegnięcia jakiemuś zdarzeniu). Chory zdaje sobie sprawę z irracjonalności wykonywanej czynności, lecz bardzo silnie przeżywany lęk nie pozwala na wyhamowanie kompulsji. Protokół terapii neurofeedback w typ przypadku ma na celu zredukowanie lękliwości i napięcia przez obniżenie tej niepożądanej aktywności. Najczęściej hamowana jest wysoka beta (21-34 Hz) w punktach F3, F4, Fz, czasem w pasie centralnym. Lubar (Thompson, 2003) proponuje wykorzystywanie protokołu tylko dla prawej strony uwzględniający redukowanie bety i podwyższanie pasma alfa. Niektórzy terapeuci proponują terapię biofeedback mającą na celu obniżenia lęku razem z protokołem neurofeedback aktywującym pasmo alfy (11-15 Hz) w puntach C4 i P4.
ALKOHOLIZM
Badania pokazują, że u osób uzależnionych od alkoholu nawet po długim okresie abstynencji występuję niższy poziom fal pasma alfa i theta oraz wyższy pasma bety (Hammond, 2006). Zjawisko to można również obserwować u ich dzieci. Powoduje to problem z osiągnięciem stanu wyciszenia i relaksu. Przyjmowanie alkoholu powoduje natomiast podnieniesie poziomu niskich fal alfa i theta. Stąd też hipoteza, że skłonność do nałogu alkoholowego może wynikać z podłoża biologicznego - deficytu niskich fal mózgowych oraz nadmiaru wysokich częstości. Osoby o takiej charakterystyce niejako równoważą tę asymetrię przez spożywanie alkoholu, chcąc uzyskać stan relaksacji. W terapii neurofeedback u osób z taką asymetrią fal stosuje się protokół alfa/theta. Ma on na celu ułatwienie wzrostu poziomu thety nad alfę w trakcie relaksacji z zamkniętymi oczami. Podczas takiej relaksacji na początkowym etapie pojawia się wysoka amplituda pasma alfa, która stopniowo ustępuje na korzyść pasma theta, które zaczyna dominować. Często towarzyszy temu wzrost delty. Punkt przejścia z częstości alfa na pasmo theta nazywany jest theta-alfa-cross-over, charakteryzuje się obniżeniem świadomości i wystąpieniem początkowych stadiów snu. Podczas treningów biofeedbacku osoby osiągały stan głębokiej relaksacji bez zasypiania. Badania nad wykorzystaniem biofeedbacku w leczeniu uzależnień, m.in. alkoholizmu były prowadzone w amerykańskich szpitalach od wczesnych lat siedemdziesiątych. Treningi neurofeedback dotyczyły niskich częstości - alfy (8-13 Hz) i thety (4-8 Hz) rejonów potylicznych. Bardzo często towarzyszyły im sesje EMG biofeedback i temperature control biofeedback. Efektem tych wieloletnch badań było opracowanie planu sesji nazwanego protokołem Penistona, od nazwiska jednego z czołowych badaczy. Trening biofeedback uzupełnił on o temperature control biofeedback oraz “skryptem” (script). Terapia zaczyna się od temperature control biofeedback, podczas którego pacjenci uczą się głębokiej relaksacji (ok. 5 sesji). Następnym krokiem jest trening neurofeedback, do którego wprowadzeniem jest “skrypt”, czyli malowniczy opis w jaki sposób osoba powinna się zrelaksować oraz na czym powinna skupić swoje wyobrażenia. Kolejny etap terapii - trening neurofeedback- wykorzystuje elektrode O1. Pacjent ma za zadanie generowanie fal alfa - po osiągnięciu progu rozbrzmiewa przyjemny dźwięk, który pacjent ma za pomocą feedbacku generować. W ten sposób osiąga on coraz niższe częstości fal i bardziej zrelaksowany stan. W momencie, gdy osiągnięty zostaje pożądany próg częstości pasma theta generowany jest inny dźwięk. Peniston określa ten stan jako “bardziej zrelaksowany i jako stan nieskrępowanej zadumy i dużej sugestywności, umożliwiający penetrację doświadczanych wyobrażeń.” (Budzyński et al., 2009) Zastosowanie tego protokołu cieszyło się bardzo dużą skutecznością i długim okresem utrzymywania się zmian.
DEPRESJA
Jedną z fizjologicznych zmian obserwowanych u osób depresyjnych jest asymetria aktywacji między prawą i lewą półkulą (Davidson, 1994). Przyjmuje się, że lewy centralny płat mózgu jest związany z pozytywnymi emocjami oraz motywacją, parciem w danym kierunku, a prawy - z negatywnymi afektami oraz wycofywaniem się. W przypadku biologicznej skłonności do depresji zaobserwowano znaczną przewagę fal alfa w lewej półkuli, co prowadzi do jej mniejszej aktywności i dysproporcji w odczuwaniu pozytywnych i negatywnych emocji na korzyść tych drugich. Podobne zjawisko zaobserwowano również u dzieci depresyjnych matek. Asymetria stwarza predylekcję do popadnięcia w zaburzenie depresyjne w przypadku długotrwałego przeżywania negatywnych emocji. Ten model aktywacji nie jest koniecznym warunkiem wystąpienia depresji, może ona wystąpić również u osób z symetrycznym wzorcem fal mózgowych. Jednym z protokołów zaproponowanych do zniesienia opisanej asymetrii jest alpha asymmetry protocol (nazywany również ALAY(Hammond, 2005)) autorstwa Rosenfelda. Wykorzystuje on formułę (F4-F3)/ (F3+F4), w której porównywana jest aktywacja prawego i lewego obszaru czołowego. Im wyższy wynik tego równania, tym asymetria jest mniejsza, gdyż czynnikiem pomiaru jest tutaj pasmo alfa. Im F3 będzie przyjmować mniejsze wartości, tym mniejsza będzie aktywność alfy, czyli większa aktywacja. Duża wartość F4 sugeruje, że jest tam przewaga pasma alfa. Pod względem funkcjonalnym obszar ten, odpowiedzialny za negatywne emocje i wycofanie, jest w spoczynku. Według E. Baehr ważna jest proporcja czasu, kiedy równanie Rosenfelda jest powyżej zera do ilości czasu kiedy daje ono wynik ujemny. Jak twierdzi badaczka, jest to dużo trafniejszy sposób diagnozowania. Jeżeli osoba 55% czasu miała wynik równania poniżej zera sugerowana jest depresja, jeśli powyżej 60% utrzymywał się rezultat dodatni, uważana jest za zdrową. Warto zwrócić uwagę, że wynik proporcji Rosenfelda nie informuje jak kształtują się jej poszczególne składowe. Nie wiadomo, czy pasmo alfa zostało wyhamowane w lewej półkuli czy nastąpiła większa jego aktywacja w prawym obszarze. Inne rozwiązanie problemu obniżonej aktywności lewego płata czołowego wysunął J.Gunkelman (Thompson, 2003). Zaproponował on, aby razem ze wzmacnianiem pasma beta lewego płata czołowego, wykorzystać drugi kanał do wzbudzania pasma wysokiej alfy (11-13 Hz) w obszarach ciemieniowych. Autor chciał w ten sposób wywołać rodzaj współzawodnictwa między tymi obszarami, wzmacniając pasmo alfa we właściwym dla niego rejonie występowania. Odmienny protokół stosował z pozytywnym skutkiem u swoich pacjentów Hammond (Hammond, 2005). Sesja treningowa została podzielona na dwie części. Pierwsze 20-22 minut w punktach Fp1 i F3 hamował on pasma niskiej alfy i thety oraz wzmacniał pasmo bety (15-18 Hz). Ostatnie 8-10 minut treningu wzmacniana była częstość 12-15 Hz. Skuteczność tego protokołu wykazał on w swoich badaniach prowadzonych na osobach z ostrą depresją. Skuteczność w walce z depresją zaobserwowali również badacze wykorzystujący trening przy pomocy LENS. Wskazują na to badania Larsona, który zauważył u swoich pacjentów znaczną poprawę już po 20 sesjach (Budzynski et al., 2009).
EPILEPSJA
Wśród osób cierpiących na epilepsję zastosowanie terapii neurofeedback odnotowuje się od początku lat siedemdziesiątych ubiegłego stulecia. Przyczynkiem do rozpoczęcia badań nad zastosowaniem tego typu terapii jako możliwego “lekarstwa”, były badania Stermana nad wpływem paliwa rakietowego na człowieka. Okazało się, że koty po treningu SMR nie cierpiały na ataki epileptyczne wywołane oparami (Egner i Sterman, 2006). Rytm SMR jest wywoływany przez wzajemne oddziaływanie jąder wzgórza i kory somatosensorycznej. Ponieważ oscylacje te są zmieniane przez neuromodulatory, dlatego warunkiem ich wystąpienia jest spokojne zachowanie i brak wzmożonej aktywności. Kontrola podniecenia i ekscytacji staje sie w ten sposób jednym z głównych celów treningu neurofeedback w ramach tego protokołu. Patologia epilepsji może w różnej formie przejawić się w sygnale EEG, mogą też nie występować żadne znaczące zmiany w stosunku do EEG osoby zdrowej. Największe prawdopodobieństwo zaobserwowania modyfikacji występuje w obszarach płata skroniowego. Postępowanie w przypadku stwierdzonej epilepsji jest dość jednoznaczne: należy wzmacniać pasmo SMR w obszarze sensomotorycznym kory w celu minimalizacji ataków. Przedstawione protokoły wykorzystywane przy poszczególnych chorobach są propozycją popartą badaniami prowadzonymi przez terapeutów i klinicystów. Neurofeedback jest jednak młodą metodą i badania nad optymalnym podejściem do konkretnych zaburzeń trwają i przynoszą coraz to nowe propozycje i sugestie postępowania z pacjentem.
Nowe trendy
Terapia przy użyciu neurofeedbacku rozwija się obecnie w dwóch różnych kierunkach. Jednym z nich jest standaryzowanie sygnału EEG, drugim rozwój osobisty i polepszenie sprawności umysłowej. Wbrew temu, co może się wydawać osobie, która dopiero rozpoczyna swoją przygodę z neurofeedbackiem, każdy trening jest przeprowadzany w inny sposób. Wiele zależy od osoby prowadzącej trening, która zależnie od własnych preferencji może przyjąć zarówno kognitywne metody skupiające się na nieprawidłowościach wykrytych w EEG, jak również dynamiczne mające na celu wprowadzenie globalnych, a nie lokalnych, zmian w EEG. Uważa się również, że terapia neurofeedback jest jedynie terapią wspomagającą i wskazane jest jej łączenie z terapią psychologiczną.
Interfejsy mózg-komputer
Celem działania interfejsów mózg-komputer (ang. brain-computer interface, BCI) jest bezpośrednie sterowanie komputerem za pomocą mózgu. Odpowiednio zaprogramowany komputer może umożliwiać, bez pośrednictwa mięśni, komunikację z otoczeniem (przez pisanie tekstów) lub sterowanie urządzeniami, np. kontrolę oświetlenia, telewizora itp. Najbardziej obiecujące są systemy BCI oparte o odczyt elektroencefalogramu (EEG). Pozostałe podejścia wymagają albo wszczepiania elektrod podczaszkowych, albo — jak systemy oparte na fMRI lub NIRS — wykazują kilkusekundowe opóźnienia, a w przypadku fMRI wymagają bardzo drogiej, nieprzenośnej aparatury (skaner fMRI z polem powyżej 3 T).
BCI oparte o EEG
Wśród BCI opartych o EEG, najefektywniej działają trzy podstawowe paradygmaty:
- SSVEP (ang. steady state visual evoked potentials), oparte o koncentrowanie uwagi na symbolu migającym z częstością, która jest odzwierciedlana w EEG. Na przykład na matrycy cyfr 3x3 każda klatka miga z inną częstością. Skoncentrowanie uwagi na jednej z cyfr powoduje pojawienie się w EEG odpowiadającej częstości.
- P300, oparte o detekcję potencjałów wywołanych przez podświetlenie np. oczekiwanej litery. Tu najczęściej podświetlane są wiersze i kolumny macierzy liter. Podświetlenie wiersza lub kolumny, w której znajduje się litera na której koncentrujemy uwagę, powoduje pojawienie się specyficznego potencjału wywołanego. Niestety jego detekcja, przy aktualnym stanie metodologii analizy sygnałów, może wymagać szeregu powtórzeń, co zmniejsza szybkość transferu informacji.
- ERD/ERS (ang. event-related desynchronization/synchronization), oparte o odczyt intencji ruchu prawą/lewą ręką i np. stopą. Ten najbardziej „naturalny” tryb sterowania przez EEG, w którym np. wyobrażenie ruchu prawą ręką może oznaczać „skręć w prawo”, a ruchu stopą — „poruszaj się do przodu”, jest jednocześnie najbardziej skomplikowany w realizacji. Odróżnienie intencji ruchu np. lewą i prawą kończyną możliwe jest częściowo dzięki lateralizacji funkcji mózgu, więc wymaga stosunkowo dużej ilości elektrod. Jeszcze trudniejsza jest detekcja samych ERD/ERS, które w „czystej” postaci widoczne są po uśrednieniu EEG z wielu powtórzeń tego samego wyobrażenia.
Zastosowania BCI
Głównym zastosowaniem BCI jest umożliwienie komunikacji ze światem zewnętrznym pacjentom w ciężkich stadiach takich chorób jak stwardnienie zanikowe boczne (ang. amyotrophic lateral sclerosis, ALS), udar mózgowy podkorowy, zespół Guillain-Barre’a, mózgowe porażenie dziecięce (ang. cerebral palsy) czy stwardnienie rozsiane (SM).
Dwa tysiące osób rocznie w Polsce (a we wszystkich krajach Unii Europejskiej około 24 tysięcy) zapada na ALS — okrutną, neurodegeneracyjną chorobę układu nerwowego, która niszczy część centralnego układu nerwowego odpowiedzialną za ruch nie uszkadza natomiast, czucia, zdolności poznawczych i intelektu. Osoby, które na nią zapadają, stopniowo tracą kontrolę nad własnym ciałem i w ciągu 2 do 3 lat osiągają stan, kiedy nie mają żadnej możliwości skomunikowania się z otoczeniem, pozostając niewolnikami własnych ciał, skazanymi na trwanie przy życiu bez możliwości wyrażenia własnych potrzeb, opinii i emocji. ALS to choroba neurodegeneracyjna przebiegająca z zanikiem neuronów w rogach przednich rdzenia kręgowego, którymi biegną sygnały ruchowe do narządów wykonawczych - mięśni. Najbardziej okrutne jest jednak to, że choroba niszcząc tylko neurony ruchowe nie upośledza w najmniejszym stopniu intelektu chorych co czyni ich więźniami własnych ciał. Chorzy ci nie mogą mówić natomiast ich inteligencja jest pełna. Są skazani na bierną obserwację tego co się z nimi dzieje bez możliwości zareagowania na ból (też nie upośledzony) czy niewygodę. Często są przez otoczenie traktowani jak upośledzeni umysłowo. Znanym wyjątkiem jest kosmolog Stephen Hawking żyjący już 40 lat z ALS i z powodzeniem prowadzący jeszcze do niedawna wykłady za pomocą generatora mowy sterowanego ruchami gałek ocznych — jest to przykład tak zwanego zależnego interfejsu mózg-komputer (ang. dependent BCI).
Uniezależnienie komunikacji od resztkowej funkcjonalności mięśni jest znacznie bardziej interesujące z naukowego punktu widzenia. Ponadto, takie niezależne interfejsy mózg-komputer (ang. indpendent BCI) są jedyną drogą komunikacji w skrajnych stadiach niektórych z tych chorób, gdy pacjent znajduje się w tzw. „completely locked-in state”: przed osiągnięciem tego stanu pacjent musi zdecydować się na podłączenie do systemu wymuszonego oddychania ze względu na zanik funkcji także mięśni oddechowych, prowadzący w przeciwnym razie do śmierci. Wbrew obiegowym opiniom, pacjenci w tym stanie wykazują się dużą wolą życia, a ich średnia ocena jakości życia bywa znacznie wyższa niż powszechnie uważamy. Na przykład, pacjenci ze stwardnieniem zanikowym bocznym w skali depresji wypadają wprawdzie gorzej niż grupa kontrolna pacjentów zdrowych, ale znacząco lepiej od pacjentów depresyjnych bez żadnych fizycznych objawów paraliżu, i mieszczą się w przedziale normy. Podobnie wypadają pomiary jakości życia (ang. quality of life). Czynnikiem, który może przyspieszać decyzję o niekorzystaniu z aparatury podtrzymującej oddychanie, może być właśnie strach przed całkowitym zamknięciem i brakiem jakiejkolwiek komunikacji z otoczeniem. W skrajnych stadiach stwardnienia zanikowego bocznego, interfejs mózg-komputer może być jedyną nadzieją na jej zachowanie.
Kolejną grupą ludzi, którym należy zapewnić możliwość porozumiewania się z otoczeniem za pomocą tegoż interfejsu jest 14 tysięcy osób jakie w ciągu roku w Polsce zapadają na udary mózgu, a w szczególności udary pnia mózgu. Aktywność kory mózgowej u tych ludzi świadczyć może o braku deficytów intelektualnych. Jedynym sposobem żeby pomóc tym ludziom nawiązać kontakt z najbliższymi jest BCI. Do wymienionych grup należałoby dołączyć 1,2 tysiąca ofiar wypadków komunikacyjnych, w wyniku których doszło do uszkodzenia szyjnego odcinka rdzenia kręgowego. Interfejs mózg-komputer na początku zastosowań zapewne posłuży do nawiązania kontaktu z sprawnymi intelektualnie umysłami uwięzionymi w okaleczonych ciałach jednak wydaje się możliwe zastosowanie go w sterowaniu ruchami oddechowymi klatki piersiowej co umożliwiłoby uniknięcie stosowania sztucznej wentylacji płuc. BCI w połączeniu ze stosowaną już od kilkudziesięciu lat w rehabilitacji metodą FES (funkcjonalna elektrostymulacja) pozwoliłoby wykonywać proste ruchy ciała, a być może w przyszłości złożone. Na rozwój tej metody czeka w Unii Europejskiej 3 miliony niepełnosprawnych ruchowo osób.
Nie jest to jedyne zastosowanie tej nabierającej znaczenia technologii. Zastosowania wojskowe są z naturalnych względów znacznie mniej reprezentowane w publikacjach, jednak wydaje się, że nakłady na te badania są również bardzo duże. Również w zakresie zastosowań rozrywkowo-mulitmedialnych. Na przykład firmy Emotiv Systems i NeuroSky reklamują już interfejsy do gier komputerowych.
Badania snu
Czas snu nie jest bynajmniej czasem braku aktywności mózgowej. Aktywność ta przybiera jednak postać niespotykaną w czasie czuwania. Nie jest też ona jednolita w ciągu snu całonocnego. Z czasem zachodzą zmiany zarówno w dominującej częstości sygnału (od stosunkowo szybkiej do wolnej, świadczącej o śnie głębokim), jak również w jego mocy. Badacze snu wyróżnili też szereg tzw. grafoelementów, składowych rytmicznych i struktur przejściowych — krótkich fragmentów sygnału wykazujących określone cechy i pojawiających się w określonych fazach snu. Podczas czuwania neurony działają w większym lub mniejszym stopniu niezależnie, natomiast podczas snu zwolnione ze swoich funkcji, sąsiednie komórki kory, zaczynają wysyłać impulsy równocześnie, ze stosunkowo niską częstością. Wyjątkiem jest sen REM (od ang. Rapid Eye Movement), w którym ciało śpi, natomiast mózg zaczyna być aktywny, jak podczas czuwania. W efekcie tej aktywności mogą m.in. powstawać marzenia senne. A wszystko przebiega w sposób cykliczny, zaczynając od stadiów płytkiego snu, schodząc stopniowo do coraz głębszych i osiągając wreszcie stadium REM. Taki schemat powtarza się w ciągu nocy 4-5 razy, wszystko w odpowiednich proporcjach pozwalając w zdrowym, normalnym śnie na zajście właściwych tym stanom procesów fizjologicznych.
Znaczenie
Informacje zawarte w sygnale EEG mają duże znaczenie kliniczne dla diagnozy wszelkiego rodzaju zaburzeń snu i chorób neurologicznych (np. przy wykluczeniu epilepsji). Na podstawie analizy zapisów polisomnograficznych (zapisów EEG, EKG, EMG podczas snu) można badać jakość snu, kontrolować sen głęboki niezbędny do rzeczywistego relaksu. Również obiektywne testowanie leków nasennych lub innych związanych z chorobami (takimi jak depresja czy nadciśnienie) przejawiającymi się bezsennością, możliwe jest przez ocenę zapisów przebiegów nocnych EEG. Określone schorzenie wiąże się ze zmianami w sygnale EEG — zanikiem niektórych fal, wzmożoną aktywnością innych, dysproporcją stadiów czy anormalnym profilem snu. Do schorzeń, przy diagnozowaniu których ma znaczenie pomiar EEG podczas snu, należą: epilepsja, insomnia (bezsenność), apnea (bezdech nocny), narkolepsja, somnambulizm i schorzenia pokrewne, hypersomnia i zaburzenia rytmu dobowego, zaburzenia zasypiania i zaburzenia lękowe.
Opis EEG snu
W praktyce klinicznej analiza EEG snu zazwyczaj sprowadza się do tzw. hipnogramu czyli opisu jaki rodzaj snu dominował w odpowiednich przedziałach czasu oraz kontroli mikrowybudzeń, bezdechów nocnych itp. Jest to dość czasochłonna i żmudna praca. W ciągu ponad 70 lat wykorzystywania EEG, postęp jaki się dokonał w dziedzinie analizy EEG dotyczy prawie wyłącznie sposobu zapisu, zbierania i wizualizacji sygnału. Natomiast analiza danych w dalszym ciągu należy do praktyki lekarskiej — kiedyś specjaliści oceniali EEG zapisane na papierze, a dzisiaj — bezpośrednio na ekranie monitora. I o ile dany sen trwał ok. 7-8 godzin (po rozwinięciu taki zapis EEG miałby długość ok. pół kilometra), to do jego dokładnej analizy potrzeba około połowy tego czasu.
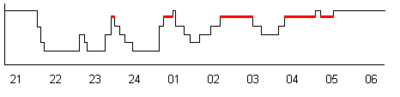
Typowy hipnogram przedstawiony jest na rys. 3. Ma on charakterystyczną strukturę tzw. „schodów snu”. Osoba usiłująca zasnąć po czasie czuwania przechodzi stopniowo w coraz głębsze stadia snu, a następnie po okresie ok. 1,5 godziny pojawia się pierwszy 5-10 minutowy sen REM. Podobny cykl trwający średnio 90 min. powtarza się w ciągu snu całonocnego. Zmienia się natomiast podział czasu między stadia, zanika sen głęboki, charakterystyczny dla pierwszej połowy snu, a wydłuża się czas trwania stadium REM.
Charakterystyczne cechy sygnału EEG w poszczególnych stadiach snu (wg. Rechtschaffen i Kales 1968)
Stadium 1: odpowiada stanowi płytkiego snu bezpośrednio po zaśnięciu bądź po okresie wzmożonego ruchu podczas snu. W EEG obserwuje się spowolnienie częstości. Zanika aktywność alfa, a jej miejsce zajmują fale theta. Charakterystyczna jest też chwilami regularna aktywność o częstości ok. 2–7 Hz i amplitudzie peak-to-peak 50–75 µV. W końcowej fazie snu mogą pojawiać się vertex sharp waves o amplitudzie do 200 µV.
Stadium 2: stanowi zazwyczaj największą część snu całonocnego. Jest stanem głębszego snu niż stadium 1. Pod względem dominującej częstości i amplitudy, zapis EEG jest podobny do zapisu ze stadium 1 z tym, że wyraźnie zaznaczona jest obecność wrzecion snu i kompleksów K. Mogą pojawiają się też inne krótkie fale wolne nie posiadające kształtu kompleksu K, jednak nie mogą one zajmować więcej niż 20% składki.
Stadium 3: stanowi jeszcze głębszy sen. Następuje zazwyczaj po Stadium 2, gdy ma miejsce zwolnienie zapisu EEG. W tym stadium 20% do 50% czasu zajmują fale delta o częstości 0 - 2 Hz i amplitudzie peak-to-peak powyżej 75 μV . Wrzeciona snu i kompleksy K mogą, choć nie muszą pojawiać się okazjonalnie w stadium 3.
Stadium 4: jest stanem najgłębszego snu. W zapisie EEG stadium 4 charakteryzuje się dominacją (powyżej 50% zapisu sygnału w składce) aktywności delta. Szybka aktywność niskoamplitudowa może pojawiać się jeszcze jedynie na kilka sekund. Wrzeciona snu i kompleksy K mogą, choć nie muszą, pojawiać się okazjonalnie w stadium 4.
Stadium REM: zwane też snem paradoksalnym, jest jednym z ciekawszych zjawisk podczas snu. Termin „sen paradoksalny” odnosi się do paradoksu polegającego na tym, że pomimo względnie małej synchronizacji w EEG (podobnej do stadium 1), sen REM jest snem głębokim. Najbardziej charakterystycznym elementem fazy REM są widoczne w zapisie szybkie ruchy gałek ocznych — Rapid Eye Movement i stąd nazwa stadium. W EEG dominują stosunkowo szybkie fale o częstości 2 – 10 Hz i małej amplitudzie. Pojawiają się ślady aktywności alfa, a także charakterystyczne dla tego stadium fale piłokształtne. W stadium REM nie obserwuje się wrzecion snu ani kompleksów K.
Faza czuwania i epizody z artefaktami ruchowymi (Movement Time) nie stanowią stadiów snu, ale są nieodłącznym składnikiem zapisów polisomnograficznych. Jako stan czuwania oznacza się odcinki EEG rejestrowane u osób bezpośrednio przed zaśnięciem. Chodzi o stan głębokiego relaksu, z zamkniętymi oczami. Ze stanem czuwania związane jest przede wszystkim występowanie silnej aktywności alfa w tylnych odprowadzeniach. Nie jest to jednak standard, ponieważ część badanych nie wykazuje wcale aktywności alfa, lub fale te są bardzo słabe w stanie głębokiego relaksu. EEG stanu czuwania charakteryzuje się niskoamplitudową aktywnością o mieszanej częstości. Mogą być obserwowane silne artefakty mięśniowe związane z przewracaniem się osoby badanej. Występują też ślady ruchów gałek ocznych i mrugnięć. EEG w momencie ruchów śpiącego zakłócone jest w większości przypadków przez artefakty pochodzące od silnego napięcia mięśni lub wzmocniony artefakt związany z poruszeniem się pacjenta.
Epilepsja
Padaczka (gr. epilepsia) jest najczęstszym schorzeniem układu nerwowego występującym u ok. 1% światowej populacji. Liczba osób, u których epilepsja występuje obecnie, występowała w przeszłości lub dopiero wystąpi, jest dwukrotnie większa tj. ok. 2% (WHO, 2001). Cechą padaczki jest pojawianie się przejściowych zaburzeń pracy mózgu, czyli tzw. napadów padaczkowych będących gwałtownymi wyładowaniami elektrycznymi w komórkach nerwowych. W zależności od obszarów mózgu, w których napad powstaje, lub do których się rozprzestrzenia, ataki padaczkowe mogą mieć różne manifestacje kliniczne. Według obowiązującej klasyfikacji, istnieje około 40 rodzajów napadów (ILAE, 1989). Możemy wśród nich wyróżnić dwa podstawowe rodzaje: napady uogólnione i częściowe. Napady uogólnione nie drgawkowe wiążą się z utratą świadomości, czemu towarzyszyć mogą inne objawy np. drganie powiek, wyprostowanie bądź drgnięcie ciała. Napady uogólnione drgawkowe wiążą się z utratą świadomości, napięciem mięśni i /lub rytmicznych drgawkach całego ciała. Podczas napadów częściowych chory zwykle nie traci świadomości. W zależności od obszarów mózgu objętych wyładowaniem napadowym mogą wystąpić rozmaite doznania wzrokowe, słuchowe, smakowe, węchowe, czuciowe lub zaburzenia ruchowe. Napady padaczkowe mogą trwać od kilku do kilkudziesięciu sekund, po czym samoistnie się kończą. Istnieje wiele odmian leków przeciwpadaczkowych. Np. napady uogólnione mogą być skutecznie kontrolowane farmakologicznie u ponad 80% pacjentów. Dla osób z napadami częściowymi, u których terapia lekowa nie jest skuteczna, istnieją inne metody terapii np. chirurgiczne usunięcie ogniska padaczkowego. Operacja może być przeprowadzona jedynie w przypadku określenia dokładnej lokalizacji ogniska. Innym sposobem na trudne do kontrolowania przypadki epilepsji jest stosowana od niedawna stymulacja elektryczna nerwu błędnego. Stymulacja odbywa się za pomocą wszczepionego stymulatora. Metoda ta, choć nie eliminuje występowania napadów, pozwala zmniejszyć ich częstość oraz złagodzić ich przebieg.
Badanie EEG
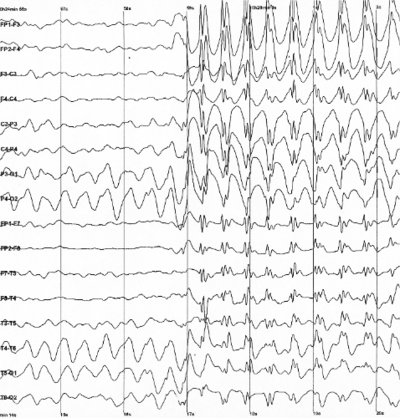
Badanie EEG jest zasadniczym składnikiem diagnostyki epilepsji. Należy jednak pamiętać, że normalny zapis EEG nie wyklucza epilepsji ponieważ zapis pomiędzy napadami może nie różnić się od zapisu u osoby zdrowej. Zapis patologiczny, z drugiej strony, nie musi jednoznacznie wskazywać na epilepsje gdyż chorobowe zapisy mogą mieć różne przyczyny. W zapisie EEG pomiędzy napadami mogą wystąpić zmiany w normalnych częstościach oraz pojawić się dodatkowe struktury np. iglice epileptyczne, co pomaga postawieniu diagnozy i prognoz na wyleczenie. Zapis napadowy pozwala natomiast odróżnić napady częściowe od uogólnionych. Na Rys. 4 pokazany jest zapis EEG napadu nieświadomości będącego napadem uogólnionym. Aktywność napadowa widoczna jest we wszystkich odprowadzeniach.
Jeśli standardowe badanie EEG nie jest wystarczające do postawienia diagnozy, wykonany może być 24-godzinny zapis EEG. U niektórych pacjentów, w celu przedoperacyjnej lokalizacji ogniska padaczkowego, dokonuje się implantacji elektrod do wnętrza mózgu lub pomiaru EEG za pomocą siatki elektrod umieszczonej na powierzchni mózgu. Zapis taki nazywa się elektrokortykogramem (ang. electrocorticogram, ECoG). Jeżeli rodzaj i przyczyna napadów nie jest znana, pacjent może być poddany obserwacji wideo-EEG. Podczas obserwacji, zapis EEG pacjenta jest rejestrowany wraz z nagraniem obrazu wideo. Zestawienie zapisu EEG z zachowaniem pacjenta, pomaga w diagnozie epilepsji i lokalizacji obszarów mózgu generujących napady. Badanie wideo-EEG może też pomóc odróżnić napady padaczkowe powodowane wyładowaniami elektrycznymi od napadów nieepileptycznych, o podłożu psychologicznym.
Farmako-EEG
Farmako-EEG jest dziedziną elektrofizjologicznych badań mózgu, w których szukamy w zapisach EEG zmian spowodowanych działaniem leków. Jest to jednocześnie dziedzina ilościowej analizy sygnałów, gdzie staramy się nie tylko znaleźć fakt istnienia różnic, ale też móc opisać te różnice w sposób umożliwiający precyzyjne opisanie nasilenia zmian.
Sytuacja wydaje się prosta, gdy efekt wpływu badanej substancji na działanie mózgu jest wyraźny. Jednakże przy niewielkich dawkach (tzw. podprogowych) możemy nie obserwować żadnych objawów zewnętrznych, zarówno w zachowaniu jak i samopoczuciu pacjentów. Zmiany mogą być jednak zaobserwowane w zmianach w zapisie EEG. Tutaj również zmiany mogą być na tyle niewielkie, że nie ujawnią się przy analizie wzrokowej. Wtedy możemy przekonać się o ich obecności stosując metody statystyczne. Badane może być zarówno EEG spontaniczne jak i wpływ na reakcję mózgu na bodźce — potencjały wywołane.
Aby wyniki były porównywalne pomiędzy pacjentami i pomiędzy badaniami, powinny być spełnione pewne standardy dotyczące nie tylko samych metod analizy sygnałów, ale także sposobu i warunków rejestracji zapisów EEG. Wdrażaniem odpowiednich standardów praktyki rejestracji oraz propagowaniem metod takiej analizy danych w różnych dziedzinach badań medycznych, biochemicznych, medycznych czy farmakologicznych zajmuje się Międzynarodowe Towarzystwo Farmako-EEG (International Pharmaco-EEG Society) organizujące materiały, konferencje oraz wydające własne czasopismo.
W farmako-EEG popularne są w szczególności parametryczne metody analizy sygnałów, dostarczające łatwych do porównania i obróbki statystycznej liczb (parametrów). Jednocześnie badane są często nie tylko zmiany w EEG, ale także inne wielkości jak zmiany w zachowaniu, rytmie serca i inne.
Literatura
Demos, J.H. Getting Started with Neurofeedback, New York, W.W. Norton & Co., 2005.
Durka, P.J., Szelenberger, W., Blinowska, K.J., Androsiuk, W., Myszka, M. Adaptive time-frequency parametrization in pharmaco EEG. Journal of Neuroscience Methods 117: 65-71, 2002.
Hammond, D.C. What is Neurofeedback, Journal of Neurotherapy, 10(4), 2006.
Hebb, D. O. The Organization of Behavior: A neuropsychological theory. New York, Wiley, 1949.
Kamiya, J. Operant control of EEG alpha rhythm and some of its reported effects on consciousness. W Tart C. (Ed.), Altered states of consciousness. New York Wiley, 519-529, 1969.
ILAE. Commission on Classification and Terminology of the International League Against Epilepsy. Proposal for revised classification of epilepsies and epileptic syndromes. Epilepsia. 30: 389-399, 1989.
Miller, N.E. Learning of visceral and glandular responses. Science, 163: 434-445, 1969.
Rechtschaffen, A. i Kales, A. (Edytorzy) A manual of standarized terminology, techniques and scoring system for sleep stages in human subjects. US Government Printing Office, 1968.
Roberts, A. Neurobiofeedback, American Psychologist, 40(8): 938-941, 1985.
Swingle, P.G. Biofeedback for the Brain: How Neurotherapy Effectively Treats Depression, ADHD, Autism and More. Rutgers University Press, 2008
Thompson, M., Thompson, L. The Neurofeedback Book: An Introduction to Basic Concepts in Applied Psychophysiology. Wheat Ridge, The Association for Applied Psychophysiology and Biofeedback, 2003.