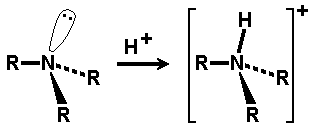CHEM:Chemia organiczna/Aminy
Spis treści
Budowa i nazwencitwo amin
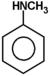
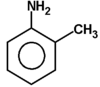
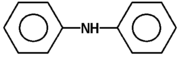
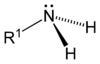
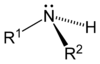
Ogólnym mianem "aminy" określa się pochodne amoniaku, w których atomy wodoru zastąpione są resztami węglowodorowymi. W zależności od tego ile takich podstawników jest związane z atomem azotu rozróżnia się aminy o różnej rzędowości (Rys. Figure 1.). Należy tu zaznaczyć, że rzędowość amin ma inne znaczenie niż rzędowość związków poznanych dotychczas. O ile w przypadku fluorowcopochodnych, alkoholi i związków nitrowych rzędowość określano na podstawie rzędowości atomu węgla, z którym dana grupa jest związana, o tyle w przypadku amin rozpatrujemy rzędowość atomu azotu.
| amina pierwszorzędowa | amina drugorzędowa | amina trzeciorzędowa |
|---|---|---|
 |
 |
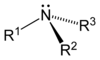 |
Aminy o różnej rzędowości, zarówno z grupami łańcuchowymi jak i aromatycznymi rozpatrujemy razem z powodu zbliżonych właściwości chemicznych. Decydujące znaczenie mają zasadowe właściwości amin wynikające z obecności wolnej pary elektronowej na atomie azotu, tak jak to pokazano poniżej na Rys. Figure 1.:
Podstawowym systemem nazewnictwa amin jest użycie rdzenia "amina" i nazw podstawników węglowodorowych wymienionych alfabetycznie w przedrostku. W przypadku amin zawierających więcej grup aminowych nazwę wyprowadza się od węglowodoru macierzystego i po łącznikowym "o" dodaje się końcówkę di- tri- itd. -amina. Natomiast gdy amina zawiera jeszcze inną grupę funkcyjną obecność grupy aminowej zaznacza się przedrostkiem "amino" z odpowiednim lokantem. Nieraz w nazwach amin drugo- i trzeciorzędowych, dla uniknięcia niejasności, nazwy podstawników związanych z azotem poprzedza się pochyłą literą N. Dla amin aromatycznych i heterocyklicznych używa się raczej nazw specjalnych. Kilka przykładów nazw amin o różnej budowie podano na Rys. Figure 3 .
Metylo-, dimetylo-, trimetylo- i etyloamina są w temperaturze pokojowej gazami. Aminy o większych cząsteczkach są cieczami, a większość aromatycznych (z wyjątkiem aniliny i kilku jej pochodnych) - ciałami stałymi. Aminy alifatyczne o niedużych cząsteczkach są dobrze rozpuszczalne w wodzie oraz charakteryzują się silnym zapachem zbliżonym do zapachu amoniaku (na ogół nieprzyjemny "rybi" zapach).
Związki aminowe (o różnej rzędowości i często wraz z innymi grupami funkcyjnymi) występują obficie w przyrodzie i stanowią nieodłączny element obiegu azotu na Ziemi. Niektóre z nich poznamy w dalszym toku wykładu omawiając białka, związki heterocykliczne i kwasy nukleinowe.
Otrzymywanie amin.
Ogólna metodą otrzymywania amin jest alkilowanie amoniaku za pomocą halogenków alkilowych. Jest to reakcja substytucji nukleofilowej (SN2 lub rzadziej SN1), z którą zapoznaliśmy się w rozdziale o sybstytucji elektrofilowej w halogenkach alkilowych. W reakcji tej amoniak i tworzące się aminy stanowią odczynniki nukleofilowe, powodujące rozerwanie wiązania węgiel-halogen i powstawanie wiązania C—N. Metoda ta nie może być zastosowana jednak do otrzymywania amin aromatycznych z uwagi na małą reaktywność halogenobenzenów (z pewnymi wyjątkami) w reakcji substytucji nukleofilowej.
RNH2 + RX → R2N+H2X-
R2NH + RX → R3N+HX-
R3N + RX → R4N+X-
W warunkach reakcji pokazanej powyżej z tworzących się soli amoniowych mogą na każdym etapie powstawać aminy w wyniku np. takiej reakcji:
- RN+H3X- + NH3 ———→ RNH2 + NH4X
i reagować dalej z utworzeniem aminy o wyższej rzędowości. Dlatego na ogół w tej metodzie trudno jest uzyskać jednorodny produkt.
Drugą ogólną metodą uzyskiwania amin są reakcje redukcji. W tym miejscu trzeba uświadomić sobie, że trójwartościowy azot w aminach znajduje się na najniższym stopniu utlenienia (-3) i aminy mogą powstawać w wyniku redukcji każdego innego związku organicznego zawierającego grupę funkcyjną z atomem azotu na wyższym stopniu utlenienia. Adekwatne przykłady reakcji redukcji różnych związków azotowych zestawione są poniżej na Rys. Figure 5. (por. także z redukcją nitrobenzenu). Rys. Figure 5. jest jednocześnie krótkim przeglądem wielu związków organicznych zawierających azot. W dalszym toku wykładu będziemy jeszcze mówić o niektórych z nich.
Reakcje amin z kwasem azotawym.
Aminy są związkami dość reaktywnymi i ulegają wielu reakcjom substytucji nukleofilowej i addycji nukleofilowej, w których odgrywają rolę silnych odczynników nukleofilowych. Te reakcje będziemy poznawać w następnych rozdziałach.
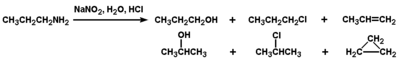
W tym miejscu zapoznamy się tylko z działaniem kwasu azotawego na aminy. Kwas azotawy, zwany też kwasem azotowym(III) o budowie H—O—N=O, jest nietrwałym, słabym kwasem nieorganicznym. Trwałe są jego sole - azotyny i z nich może on być generowany w środowisku jakiejkolwiek reakcji. Między innymi znalazł on zastosowanie w organicznej chemii analitycznej do prób jakościowych określania rodzaju amin.
Pierwszorzędowe aminy alifatyczne pod działaniem kwasu azotawego rozkładają się z wydzieleniem azotu. Badania mechanizmu tej reakcji dowodzą, że w stanie pośrednim, po
| Fe, HCl | |||
| CH3CH2CH2NO2 | ————→ | redukcja związków nitrowych | |
| Na/Hg, H2O | |||
| CH3(CH2)5CH=N—OH | ————→ | CH3(CH2)5CH2NH2 | redukcja oksymów |
| Na/Hg, H2O | |||
| C6H5CH=NC2H5 | ————→ | C6H5CH2NHC2H5 | redukcja imin |
| Na, C2H5OH | |||
| C6H5CH2C≡N | ————→ | C6H5CH2CH2NH2 | redukcja nitrylów |
| LiALH4 | |||
| C2H5N≡C | ————→ | C2H5NHCH3 | redukcja izonitrylów |
| LiALH4 | |||
| C6H5CH2CH2N3 | ————→ | C6H5CH2CH2NH2 | redukcja azydków |
| (—N=N=N) | ————→ | (N2 + —NH2) | |
| LiALH4 | |||
| CH2(CONH2)2 | ————→ | CH2(CH2NH2)2 | redukcja amidów |
rozpadzie wiązania C—N i wydzieleniu się azotu tworzy się karbokation (nietrwały, a więc bardzo reaktywny), a różne produkty końcowe są wynikiem przemian tego karbokationu. Przykład takiej reakcji pokazany jest poniżej na Rys. Figure 6.
Okazuje się natomiast, że produkt reakcji pierwszorzędowych amin aromatycznych z kwasem azotawym jest bardziej trwały i w niskiej temperaturze 0-10°C nie rozkłada się z wydzieleniem azotu. Produktem tym jest sól diazoniowa o strukturze: ArN≡N+X-, w której występuje wiązanie azot-azot, sprzężone z układem elektronów [math]\pi[/math] pierścienia aromatycznego. Właśnie dzięki temu sprzężeniu (efekt mezomeryczny) układ takiego kationu jest w miarę trwały, w przeciwieństwie do analogicznego kationu w układzie alifatycznym, w którym efekt mezomeryczny się nie pojawia, a hipotetyczny kation rozkłada się od razu z wydzieleniem azotu (i utworzeniem wspomnianego w poprzednim akapicie karbokationu).
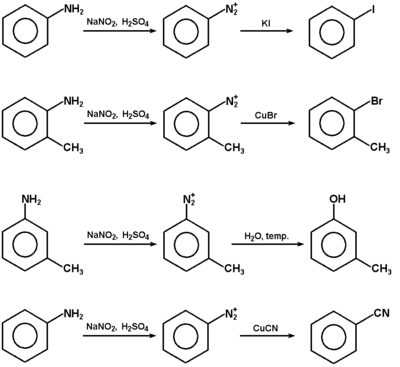
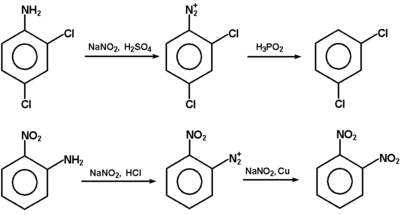
Sole diazoniowe, mimo że na ogół nie są wyodrębniane w stanie czystym, znalazły szerokie zastosowanie w syntezie organicznej. Schematy na następnej stronie obrazują różne możliwości wykorzystania soli diazoniowych. Podsumowując, łatwy do wykonania ciąg reakcji: węglowodór aromatyczny → aromatyczny związek nitrowy → amina aromatyczna → sól diazoniowa, stanowi podstawę wielu gałęzi przemysłu chemicznego i farmaceutycznego.
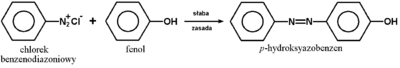
Reakcja przedstawiona na Rys. Figure 9. pod względem mechanizmu jest przykładem substytucji elektrofilowej do pierścienia aromatycznego. Odczynnikiem elektrofilowym jest sam jon benzenodiazoniowy, który atakuje inny pierścień aromatyczny zawierający grupę aktywującą (np. OH lub NH2, patrz reakcje fenoli i substytucja elektrofilowa w aminach aromatycznych). W efekcie tworzy się układ zawierający wiązanie N=N sprzężone z dwoma układami aromatycznymi (wiązanie zdelokalizowane obejmujące swym zasięgiem oba pierścienie aromatyczne, wiązanie N=N i często również poboczne grupy funkcyjne przy pierścieniach aromatycznych). Takie układy sprzężone wykazują absorpcję promieniowania elektromagnetycznego w zakresie światła widzialnego, a więc są barwne. Stosując różne pod względem budowy substraty aminowe do wytworzenia odpowiednich soli diazoniowych i różne substraty ulegające sprzęganiu można uzyskiwać szeroki wachlarz barw. Barwniki takie są stosowane jako wskaźniki do miareczkowania kwasów i zasad (alkacymetria), a przede wszystkim są wykorzystywane na olbrzymią skalę w przemyśle tkackim do barwienia tkanin. Zapotrzebowanie na tanie i łatwo dostępne barwniki w przemyśle włókienniczym leżało właśnie u podstaw burzliwego rozwoju chemii organicznej związków aromatycznych w drugiej połowie XIX wieku.
Substytucja elektrofilowa w aminach aromatycznych.
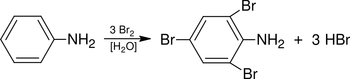
Grupa aminowa i inne grupy pochodne (np. N-alkilo- i N-acyloaminowe) wywierają wpływ aktywujący w warunkach reakcji substytucji elektrofilowej w pierścieniu aromatycznym oraz kierują następne podstawniki w położenie orto i para. Grupa aminowa, N-alkilo- i N,N'-dialkiloaminowa zaliczane są do podstawników silnie aktywujących. Jednak należy dodać, że niektórych reakcji substytucji, jak na przykład reakcji nitrowania w zwykłych warunkach, nie można w praktyce wykonać z uwagi na reakcje uboczne utleniania się aminy do produktów smolistych i niebezpieczeństwa wybuchu (kwas azotowy wykazuje w określonych warunkach właściwości utleniające). Przykład podstawienia w pierścieniu aniliny pokazany jest niżej na Schemacie Figure 10. Również należy zaznaczyć, że w środowisku silnie kwaśnym szybkość substytucji elekrofilowej znacznie maleje, ponieważ w tworzącej się soli amoniowej (ArNH3+) grupa NH3+ wywiera raczej wpływ dezaktywujący.