Chemia organiczna/Fenole
Spis treści
Budowa i nazewnictwo fenoli
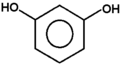
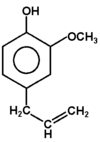
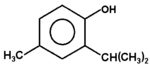
Fenolami nazywa się związki, w których grupa hydroksylowa związana jest bezpośrednio z pierścieniem aromatycznym. Nazwa całej klasy tych związków pochodzi od zwyczajowej nazwy najprostszego przedstawiciela fenolu (hydroksybenzenu). Kilka przykładów budowy różnych fenoli pokazuje poniższy Rys. Figure 1. Sam fenol i niektóre pochodne są związkami trującymi, ale wiele pochodnych fenoli wchodzi w skład związków naturalnych jak np. roślinnych olejków eterycznych. Substancje fenolowe tworzą roślinne struktury ligniny.
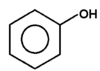
|
fenol | 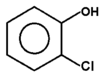
|
o-chlorofenol |
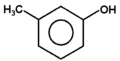
|
m-krezol | 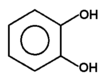
|
pirokatechina |
|
rezorcyna | 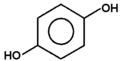
|
hydrochinon |
|
eugenol (olejek goździkowy) | 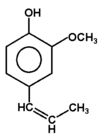
|
izoeugenol (olejek muszkatołowy) |
|
tymol (olejek z tymianku i mięty) | 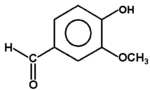
|
wanilina (olejek wanilinowy) |
Kwasowość fenoli
Kwasowość atomów wodoru
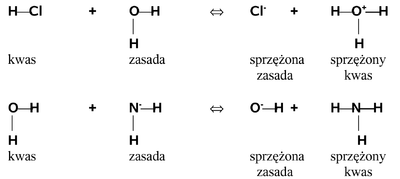
Atom wodoru jako cząstka o małej masie jest podatny na wszelkie oddziaływania z elektronami od innych układów. Szczególne znaczenie ma jego zdolność oddysocjowania w postaci kationu (protonu), o czym już kilkakrotnie było mówione. Ta zdolność ujawnia się w cząsteczkach, w których para elektronowa tworząca wiązanie z wodorem jest przesunięta w kierunku atomu związanego z wodorem. Tym drugim atomem może być każdy atom o większej elektroujemności od wodoru jak na przykład atom chloru w chlorowodorze, ale także atom węgla w odpowiednim układzie ściągającym elektrony jak na przykład przy potrójnym wiązaniu. Taka polaryzacja wiązania powoduje, że atom wodoru może zostać "przechwycony" jako proton (czyli bez elektronu) przez inny układ bogaty w elektrony. W ujęciu teorii kwasowo-zasadowej związków chemicznych układ oddający proton (lub w szerszym ujęciu akceptujący elektrony) nazywamy kwasem, zaś układ przyjmujący proton (bądź w szerszym ujęciu uwspólniający elektrony) nazywamy zasadą. Teoria ta jest na tyle ogólna, że nie ustala z góry jaka substancja jest kwasem, a jaka zasadą. Prawie każdy (tzn. z wyjątkiem najmocniejszego) kwas w warunkach reakcji z innym, mocniejszym kwasem może być zasadą, i odwrotnie (prawie) każda zasada może zachowywać się jak kwas w styczności z silniejszą zasadą. Wzajemne relacje można zapisać następującym równaniem:
| H-A | + | :Z | A:- | + | H—Z+ | |
| kwas | zasada | sprzężona zasada |
sprzężony kwas |
Poniższy Rys. Figure 2. podaje proste przykłady ilustrujące to równanie z udziałem wody, raz w roli zasady oraz w drugim przypadku w roli kwasu:
Miarą kwasowości związku jest stała kwasowości oznaczana symbolem [math]K_a\;[/math]. Stałą kwasowości oraz jej wartość pochodną [math]\mathrm{p}K_a\;[/math] definiuje się następująco:
- HA + H2O
 A- + H3O+
A- + H3O+ - [math]K_{eq} = \frac{[\mathrm H_3\mathrm O^+][\mathrm A^-]}{[\mathrm H\mathrm A][\mathrm H_2\mathrm O]} [/math]
[math]K_{eq}[/math] oznacza stałą równowagi reakcji, a w nawiasach kwadratowych wyrażone są stężenia reagentów w mol/l.
- [math]K_a = K_{eq} [\mathrm H_2\mathrm O]=\frac{[\mathrm H_3\mathrm O^+][\mathrm A^-]}{[\mathrm H\mathrm A]},[/math]
gdzie dla [H2O] przyjmuje się wartość stałą 55,6 mol/l.
W zależności od mocy kwasu wartości Ka wahają się od 10-60 dla kwasów najsłabszych do 1015 dla kwasów najmocniejszych.
- [math]\mathrm{p}K_a=-\log K_a\;[/math]
W chemii organicznej mamy do czynienia raczej z kwasami słabymi, w zakresie pKa od 1 do ok. 25. Warto pamiętać, że zgodnie z tą definicją [math]\mathrm{p}K_a\;[/math], jej większa wartość oznacza słabszy kwas. Właściwości kwasowo-zasadowe substancji należą do podstawowych wartości charakteryzujących związki chemiczne, i często o nich będziemy mówili.
Fenole jako kwasy organiczne.
Fenole wyodrębnia się w oddzielną klasę związków od alkoholi przede wszystkim z powodu ich większej kwasowości. Wartość [math]\mathrm{p}K_a\;[/math], fenolu wynosi 9,9, a więc jest on o kilka rzędów wielkości silniejszym kwasem niż alkohole. Alkohole wykazują słabsze właściwości kwasowe od wody ([math]\mathrm{p}K_a \leq 16\;[/math] wobec [math]\mathrm{p}K_a = 15,74\;[/math] dla wody), i w zwykłym tego słowa znaczeniu nie są do kwasów zaliczane. Na przykład, w przeciwieństwie do alkoholi, fenole reagują z silnymi zasadami tworząc sole fenolany:
- ArOH + NaOH —→ ArO-Na+ + H2O
Jednak w skali bezwzględnej kwasowości właściwości fenoli porównujemy do najsłabszych kwasów nieorganicznych:
- ArOH + NaHCO3 —X→ brak reakcji
- ArONa + H2CO3 —→ ArOH + NaHCO3
Powyższe dwa przykłady reakcji wskazują, że fenole są słabszymi kwasami od słabego kwasu nieorganicznego — kwasu węglowego, bowiem nie wypierają go z jego soli, a za to fenolany są rozkładane przez ten kwas.
Reakcje fenoli.
Grupa hydroksylowa fenoli w wielu reakcjach zachowuje się podobnie jak grupa hydroksylowa w alkoholach, na przykład fenole w odpowiednich warunkach tworzą estry i etery:
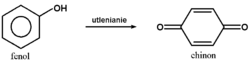
Fenole stosunkowo łatwo ulegają też utlenianiu, przy czym reakcja utleniania jest bardziej złożona niż w przypadku alkoholi:
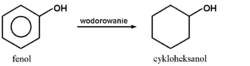
Redukcja fenolu prowadzi do uwodornienia pierścienia aromatycznego z zachowaniem grupy hydroksylowej:
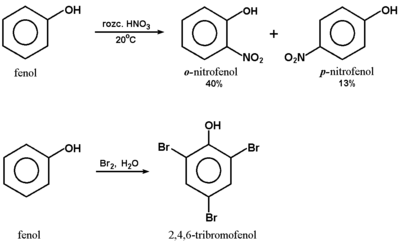
Pierścień aromatyczny fenoli podatny jest również na substytucję elektrofilową, przy czym grupa hydroksylowa należy do podstawników silnie aktywujących i kierujących w pozycje orto i para. Przykłady takich reakcji podane są na Schemacie Figure 6. Należy zwrócić uwagę na łagodne warunki reakcji pokazanych na tym schemacie. Dużą reaktywność pierścienia w fenolu tłumaczy się w oparciu o efekty elektronowe w sposób
analogiczny do opisanego dla chlorobenzenu. Przy czym tlen jest pierwiastkiem o mniejszej elektroujemności niż chlor i jego efekt indukcyjny osłabiania gęstości elektronowej w pierścieniu jest nikły, a efekt mezomeryczny związany ze sprzężeniem wolnych par elektronowych na atomie tlenu z elektronami [math]\pi[/math] pierścienia znacznie silniejszy niż w przypadku chlorobenzenu, co w rezultacie przyczynia się do wydatnego zmniejszenia energii aktywacji reakcji substytucji elektrofilowej w fenolach w pozycji orto i para.
Zastosowanie fenolu
Fenol ma duże znaczenie w przemyśle chemicznym. Produkowany jest w pokaźnych ilościach przede wszystkim syntetycznie z węglowodorów aromatycznych. Tradycyjnie wyodrębnia się go i jego pochodne również ze smół pogazowych (odgazowanie czyli sucha destylacja węgla). Zużywany jest przede wszystkim do produkcji żywic termoutwardzalnych (bakelit, żywice fenolowo-formaldehydowe), oraz w przemyśle farmaceutycznym.