Pracownia Podstaw Biofizyki/PPB5
Ultrawirowanie analityczne — wyznaczanie współczynnika sedymentacji albuminy z krwi wołu (BSA) dr Anna Modrak-Wójcik
Spis treści
Wstęp
Celem ćwiczenia jest zapoznanie się z zasadą działania i obsługi ultrawirówki analitycznej oraz wyznaczenie współczynnika sedymentacji albuminy pochodzącej z krwi wołu.
Metody ultrawirowania analitycznego umożliwiają charakterystykę makrocząsteczek biologicznych w ich stanach natywnych w roztworze, czyli w warunkach najbardziej zbliżonych do warunków panujących w komórkach, bez istnienia zaburzających oddziaływań, np. z matrycami (chromatografia, elektroforeza), czy powierzchniami (mikroskopia sił atomowych). Dostarczają informacji na temat jednorodności próbki (zanieczyszczenia, agregaty), pozwalają na określenie masy cząsteczkowej i kształtu makrocząsteczek. Umożliwiają też badanie tworzenia się i rozpadu kompleksów oraz wyznaczanie stałych równowagi dla asocjujących układów.
Ze względu na zautomatyzowanie sposobu zbierania danych i ich obróbki oraz pojawienie się nowych programów obliczeniowych i szybkich komputerów, metody ultrawirowania, zapoczątkowane na początku ubiegłego stulecia, przeżywają obecnie swój renesans.
Podstawy fizyczne ultrawirowania
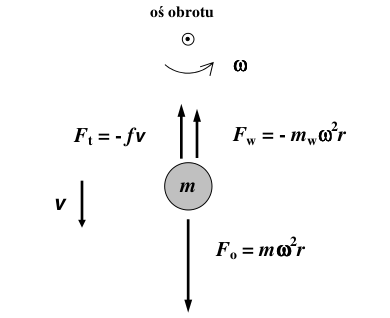
Rozważmy, co będzie działo się z cząsteczką o masie [math]m\;[/math] znajdującą się w roztworze, gdy poddamy ją wirowaniu z prędkością kołową [math]\omega\;[/math]. Działają na nią trzy siły: siła odśrodkowa [math]F_\mathrm{o}\;[/math], siła wyporu [math]F_\mathrm{w}\;[/math] oraz siła tarcia dynamicznego [math]F_\mathrm{t}\;[/math]. Siły te opisane są przez wyrażenia zamieszczone na poniższym schemacie:
gdzie [math]f\;[/math] to współczynnik tarcia, [math]v\;[/math] — prędkość ruchu cząsteczki, [math]m_\mathrm{w}\;[/math] — masa wypartej przez cząsteczkę cieczy, [math]r\;[/math] — odległość cząsteczki od osi obrotu. Znaki „-” przed siłami tarcia i wyporu pokazują, że siły te działają w przeciwnym kierunku do siły odśrodkowej. W ciągu bardzo krótkiego czasu (rzędu 10-6 s) siły te równoważą się, a cząsteczka porusza się ruchem jednostajnym:
- [math]F_\mathrm{o} + F_\mathrm{w} + F_\mathrm{t} = m\omega^2r- m_\mathrm{w}\omega^2r - fv = m\omega^2r- V\rho\omega^2r - fv = m\omega^2r - m\rho\omega^2r - fv = 0\;[/math]
W powyższej zależności masa wypartej cieczy [math]m_\mathrm{w}\;[/math] została zastąpiona wyrażeniem [math]m_\mathrm{w} = V\rho = m\bar{v}\rho\;[/math], gdzie [math]V\;[/math] to objętość cząsteczki, [math]\rho\;[/math] — gęstość cieczy (rozpuszczalnika), a [math]\bar{v}[/math] to cząstkowa objętość właściwa cząsteczki, zdefiniowana jako objętość przypadająca na jednostkę masy.
Warunek równoważenia się sił prowadzi do tożsamości będącej definicją współczynnika sedymentacji [math]s\;[/math], jako prędkości cząsteczki na jednostkę przyspieszenia odśrodkowego:
gdzie [math]M\;[/math] — masa molowa cząsteczki, a [math]N_\mathrm{A}\;[/math] — liczba Avogadro [math]\left( m = \nicefrac{M}{N_\mathrm{A}}\right)\;[/math]. Współczynnik sedymentacji zależy jedynie od parametrów opisujących badaną molekułę i rozpuszczalnik — od masy molowej i cząstkowej objętości właściwej makrocząsteczki, od współczynnika tarcia (a co za tym idzie od kształtu cząsteczki i lepkości rozpuszczalnika) oraz od gęstości rozpuszczalnika. Współczynnik sedymentacji wyrażamy w Svedbergach,
- 1 Svedberg [S] = 10-13 sekundy.
Korzystając z równania Einsteina opisującego współczynnik dyfuzji [math]D\;[/math]:
gdzie [math]R\;[/math] — stała gazowa, a [math]T\;[/math] — temperatura w Kelwinach oraz z zależności (Equation 1) otrzymujemy równanie Svedberga:
Wynika z niego, że pomiary współczynników sedymentacji i dyfuzji umożliwiają wyznaczenie masy molowej makrocząsteczki.
Zasada działania ultrawirówki analitycznej XL-I
Wirówki analityczne, w odróżnieniu od preparatywnych, wyposażone są w optyczny system detekcji umożliwiający obserwację i rejestrację rozkładu stężenia próbki podczas wirowania. Monopolistą na rynku wirówek analitycznych jest firma Beckman Coulter. Standardowo, detekcja rozkładu stężenia oparta jest na pomiarze absorpcji i/lub interferencji światła (Rys Figure 1). Znajdująca się w Zakładzie Biofizyki ultrawirówka posiada dodatkowo fluorescencyjny system detekcji.
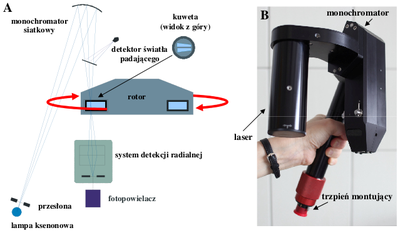
Tytanowy rotor (Rys Figure 2) oraz monochromator i laser (Rys. Figure 1B) umieszcza się w termostatowanej komorze wirówki. Podczas wirowania w komorze utrzymywana jest próżnia. W rotorze znajdują się cylindryczne otwory (4 lub 8) o osiach równoległych do osi obrotu, w których umieszcza się kuwety z badanymi próbkami (Rys. Figure 2). Maksymalna dopuszczalna prędkość wirowania wynosi 60 000 obrotów na minutę, co jest równoważne przyspieszeniu odśrodkowemu równemu 290 000 g.
Kuwety analityczne, w których odbywa się pomiar składają się z kilku części, między innymi z okienek ze szkła kwarcowego lub szafirowego oraz z części centralnej (centerpiece), zawierającej zbiorniczki o przekroju poprzecznym w kształcie wycinków koła, w których umieszcza się badaną próbkę i rozpuszczalnik (Rys. Figure 3). Części te, w ustalonej kolejności, umieszcza się w specjalnej aluminiowej obudowie i skręca w specjalnym imadle. Po skręceniu, kuwetę napełnia się przez dziurki w obudowie, dziurki te zaślepia się śrubkami. Części centralne dobiera się w zależności od typu eksperymentu (Rys. Figure 3). Droga optyczna kuwety, w zależności od rodzaju części centralnej, wynosi 12 lub 3 mm.
Typy eksperymentów ultrawirowania
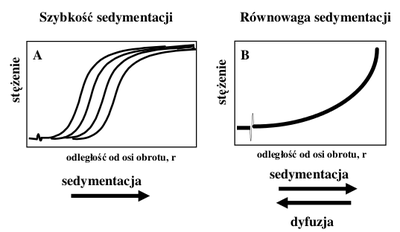
Standartowo wykonywane są dwa typy doświadczeń – eksperyment szybkości sedymentacji (ang. sedimentation velocity) i równowagi sedymentacyjnej (ang. sedimentation eqilibrium). W pierwszym z nich próbkę, początkowo jednolitą pod względem rozkładu stężenia, poddaje się działaniu znacznych sił odśrodkowych, co powoduje przesuwanie się cząsteczek rozpuszczonych w kierunku dna kuwety i powstanie ostrej granicy miedzy rozpuszczalnikiem i roztworem (Rys. Figure 4A). Granica ta przemieszcza się z prędkością określoną przez prędkość sedymentacji badanej makrocząsteczki. Rejestracja rozkładu stężenia próbki wzdłuż kuwety w funkcji czasu umożliwia wyznaczenie współczynnika sedymentacji, współczynnika dyfuzji (z rozmycia granicy), a także masy molowej (z równania Svedberga). Czas trwania pojedynczego eksperymentu jest rzędu kilku godzin.
Drugi ze wspomnianych eksperymentów — pomiar równowagi sedymentacyjnej — przeprowadzany jest przy nieco niższych prędkościach obrotowych. Po odpowiednio długim czasie (rzędu kilkunastu-kilkudziesięciu godzin) dochodzi do ustalenia się równowagi między procesem sedymentacji i dyfuzji. Powstaje gradient stężenia cząsteczek rozpuszczonych (Rys. Figure 4B), którego rozkład w równowadze nie zależy od czasu. Analiza danych doświadczalnych prowadzi do określenia równowag asocjacyjnych oraz mas cząsteczkowych składników kompleksów.
W ramach niniejszego ćwiczenia zapoznasz się z pierwszym z dwóch typów eksperymentów ultawirowania — z metodą szybkości sedymentacji.
Wyznaczanie współczynnika sedymentacji na podstawie eksperymentu szybkości sedymentacji
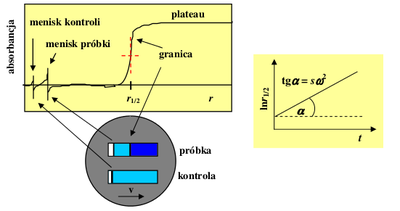
Istnieje kilka metod wyznaczania współczynnika sedymentacji na podstawie eksperymentów szybkości sedymentacji. Tutaj zostanie szczegółowo omówiona tylko jedna z nich, tzw. metoda „punktu środkowego” (ang. midpoint method). W metodzie tej zakłada się, że prędkość ruchu rozpuszczonych makrocząsteczek jest w przybliżeniu równa prędkości przesuwania się środka granicy (Rys.5). Prędkość ta jest pochodną położenia środka granicy [math](r_\nicefrac{1}{2})\;[/math] po czasie. Położenie środka granicy wyznacza punkt o wartości absorbancji w połowie między wartościami absorbancji obu obszarów plateau.
Korzystając z definicji współczynnika sedymentacji (równanie Equation 1):
- [math]s\equiv\frac{v}{\omega^2r_\nicefrac{1}{2}} = \frac{\frac{\mathrm d\omega^2r_\nicefrac{1}{2}}{\mathrm dt}}{\omega^2r_\nicefrac{1}{2}}\;[/math],
po rozdzieleniu zmiennych:
- [math]s\omega^2\mathrm dt = \frac{\mathrm dr_\nicefrac{1}{2}}{r_\nicefrac{1}{2}}\;[/math],
i obustronnym scałkowaniu, otrzymujemy zależność:
z której wynika, że wykres [math]\ln r_\nicefrac{1}{2}\;[/math] w funkcji czasu jest liniowy, ze współczynnikiem nachylenia równym [math]s\omega^2\;[/math] (Rys. Figure 5).
Tak jak już wcześniej wspomniano, współczynnik sedymentacji zależy od gęstości rozpuszczalnika oraz lepkości roztworu. Wielkości te z kolei zależą od temperatury. Aby móc porównywać ze sobą wartości [math]s\;[/math] uzyskane w różnych warunkach eksperymentalnych (temperatura, bufor), przelicza się uzyskane wartości współczynników sedymentacji dla tzw. warunków standardowych, czyli dla wody w 20 °C zgodnie z zależnością:
Indeks [math]T,b\;[/math] odnosi się do wartości cząstkowej objętość właściwej makrocząsteczki [math](\bar{v})\;[/math], gęstości [math](\rho)\;[/math] i lepkości [math](\eta)\;[/math] buforu w temperaturze, w której przeprowadzono dany eksperyment [math](T)\;[/math]; indeks [math]20,\mathrm w\;[/math] oznacza warunki standardowe (woda, 20 °C).
Należy też pamiętać, że współczynnik sedymentacji zależy od stężenia próbki. Homogenne, nie asocjujące cząsteczki wykazują spadek współczynnika sedymentacji wraz ze wzrostem stężenia. Efekt ten jest niewielki dla białek globularnych, staje się znaczący dla cząsteczek o wydłużonym kształcie lub zdenaturowanych. Wywołany jest wzrostem lepkości roztworu przy wyższych stężeniach badanej próbki.
Wymagania do kolokwium wstępnego
- Zjawisko absorpcji promieniowania elektromagnetycznego, prawo Lamberta-Beera.
- Podstawy fizyczne ultrawirowania: wyprowadzenie równania Svedberga, definicja współczynnika sedymentacji.
- Zasada działania ultrawirówki analitycznej: różnice między wirowaniem analitycznym i preparatywnym, metody detekcji sedymentujących cząsteczek i zakres ich stosowalności.
- Typy eksperymentów ultrawirowania.
- Zastosowanie metod ultrawirowania w badaniach makrocząsteczek biologicznych.
Wykonanie ćwiczenia i opracowanie danych
Podczas ćwiczenia przeprowadzisz eksperyment ultrawirowania typu szybkości sedymentacji i określisz na jego podstawie współczynnik sedymentacji albuminy z krwi wołu (BSA) metodą pomiaru położenia środka granicy w funkcji czasu. Rozkład stężenia podczas wirowania wyznaczysz rejestrując profile absorpcyjne próbek dla 280 nm. Zastanów się dlaczego w przypadku białek używana jest taka długość fali.
Masz do dyspozycji wyjściowy roztwór albuminy o stężeniu 2,5 mg/ml w 20 mM buforze Tris-HCl pH 7,0 zawierającym 0,1 M NaCl.
- Przygotuj trzy kolejne rozcieńczenia roztworu wyjściowego albuminy (S) wg poniższej tabeli. Oblicz stężenie i absorbancję próbek w 280 nm dla drogi optycznej równej 12 mm. Współczynnik ekstynkcji albuminy wynosi [math]\varepsilon^{0,1\%}(280) = 0,667\;[/math] ([math]\varepsilon^{0,1\%}\;[/math] odpowiada absorbancji 0,1% roztworu, czyli 1 mg/ml, w kuwecie o drodze optycznej 1 cm).
rozcieńczenie nr objętość buforu [ml] objętość albuminy [ml] nazwa próbki albuminy Stężenie albuminy [mg/ml] Absorbancja w 280 nm 1 0,5 0,5 S 2 0,5 0,5 1 3 0,5 0,5 2 - Następny krok to przygotowanie, napełnienie i załadowanie kuwet z próbkami do rotora. Ze względu na to, że czynności te wymagają dużego doświadczenia, a części są bardzo drogie i łatwo je uszkodzić, ten etap eksperymentu zostanie wykonany przez asystenta. Twoim zadaniem będzie obserwacja kolejnych czynności.
Do eksperymentu użyjemy dwusektorowych części centralnych o drodze optycznej 12 mm (Rys. Figure 3) oraz 4-dziurowego rotora (Rys. Figure 2). Po skręceniu, każdą z trzech kuwet (mamy trzy próbki) napełniamy w sposób następujący: lewy sektor – 400 μl buforu, prawy sektor – 390 μl białka (kuwetę kładziemy nakrętką w naszą stronę). Różne wartości objętości buforu i roztworu białka pozwalają na równoczesną obserwację obu menisków (Rys. Figure 5), co z kolei umożliwia wykrycie nieszczelności kuwety.
Następnie sprawdzamy masy kuwet po napełnieniu — parami muszą się równoważyć (tolerancja do 0,5 g). Kuwety umieszczamy w otworach rotora (zgodnie z numeracją próbek). Otwór nr 4 przeznaczony jest dla przeciwwagi, której masę koryguje się stosownie do masy kuwety nr 2 poprzez wkręcanie odważników w formie śrubek. Przeciwwaga służy do radialnej kalibracji systemu optycznego i musi być zawsze obecna podczas wirowania w pozycji nr 4 dla rotora 4-dziurowego i nr 8 dla rotora 8-dziurowego. Po umieszczeniu rotora z próbkami w komorze wirówki, montujemy monochromator (Rys. Figure 1B), zasuwamy pokrywę i uruchamiamy pompę próżniową poprzez wciśnięcie przycisku VACUUM. - Z pomocą asystenta, korzystając z software ultrawirówki ustaw parametry eksperymentu:
- temperatura 20 °C,
- obroty 42 000 rpm,
- detekcja absorpcyjna w 280 nm,
- rejestracja rozkładów radialnych co 5 minut,
- całkowita liczba zarejestrowanych rozkładów dla każdej z próbek — 150.
- Czekając na ustalenie się próżni i temperatury, wykonaj przy niskich obrotach rotora (3000 rpm) widma absorpcyjne próbek w zakresie 240-320 nm dla wybranego punktu kuwety (np. dla r = 6,5 cm, r to odległość od osi obrotu; kuweta „rozciąga się” w zakresie 5,8-7,2 cm). Zarejestruj również profile radialne każdej z próbek w 280 nm. Czy rozkład stężenia w białka w kuwetach jest jednorodny? Czy absorbancja w 280 nm jest zgodna z Twoimi wcześniejszymi obliczeniami? (patrz tabela)
- Po ustaleniu się próżni i temperatury rozpocznij eksperyment. Ponieważ wirowanie potrwa kilka godzin, czas ten wykorzystamy do nauki analizy wyników na przykładzie danych pochodzących z identycznego eksperymentu dla tej samej próbki wyjściowej BSA. Swoje własne dane otrzymasz następnego dnia e-mailem i opracujesz samodzielnie wg poniższych wskazówek.
- Korzystając z programu ORIGIN, dla 8-10 kolejnych profili (pierwszy zarejestrowany po około 40 minutach) określ położenia środków granicy [math]r_\nicefrac{1}{2}\;[/math]. Następnie wykreśl zależność ln(r1/2) w funkcji czasu, dopasuj zależność liniową i korzystając z równania Equation 5 wyznacz współczynnik sedymentacji (pamiętaj o zamianie jednostek na jednostki układu SI). Powyższe postępowanie przeprowadź dla każdej z trzech próbek.
- Aby wyznaczyć wartość współczynnika sedymentacji w warunkach standardowych musisz znać parametry opisujące użyty w eksperymencie bufor i wodę w temperaturze 20 °C (lepkość, gęstość) oraz cząstkową objętość właściwą BSA. Do wyliczania tych wielkości służy ogólnie dostępny program SEDNTERP (http://jphilo.mailway.com/download.htm). Umożliwia on wyznaczenie lepkości i gęstości roztworów składających się z różnych komponentów i w różnych temperaturach oraz cząstkowej objętości właściwej białek na podstawie ich składu aminokwasowego. Sekwencję BSA (Bovine Serum Albumin) znajdziesz w bazie UniProt (http://www.uniprot.org/).
Opis końcowy
Opis końcowy powinien zawierać poszczególne elementy charakterystyczne dla raportu z przebiegu eksperymentu (streszczenie, wstęp teoretyczny, opis układu doświadczalnego oraz wyniki i ich dyskusję). Opracowanie wyników powinno zostać przeprowadzone wg schematu przedstawionego powyżej i udokumentowane za pomocą czytelnych tabel i wykresów. Należy wyznaczyć współczynniki sedymentacji BSA dla trzech różnych stężeń białka w buforze eksperymentalnym oraz w warunkach standartowych (woda, 20 °C) i porównać uzyskane wartości z danymi literaturowymi.
Literatura
- Materiał z zakresu ultrawirowania, przedstawiony w trakcie wykładu i ćwiczeń „Metody biofizyki molekularnej”
- „Biofizyka. Wybrane zagadnienia wraz z ćwiczeniami”, red. Z. Jóźwiak i G. Bartosz, PWN 2007
- „Biofizyka molekularna”, Genowefa Ślósarek, PWN 2011
- „Modern analytical ultracentrifugation in protein science: A tutorial review”, J. Lebowitz, M. S. Lewis, P. Schuck, Prot. Science 11, pp. 2067-2079, 2002