Pracownia Podstaw Biofizyki/PPB8
Spektroskopia 1H NMR — asocjacja między zasadą modyfikowaną a zasadami potencjalnie komplementarnymi na przykładzie N6-metoksyadeniny
Wariant 1: wyznaczenie selektywnej asocjacji i stałej asocjacji dla kompleksu z cytydyną
dr hab. Borys Kierdaszuk
Spis treści
Wstęp
Molekularną podstawą specyficzności między zasadami kwasów nukleinowych jest precyzyjny system cyklicznych wiązań wodorowych tworzonych miedzy zasadami purynowymi i pirymidynowymi. Wiązania te są specyficzne, ponieważ adenina tworzy pary komplementarne tylko z uracylem (tyminą) a guanina tylko z cytozyną i obrazują komplementarność znalezioną przez Watsona i Cricka w strukturze DNA. W oryginalnej pracy z 1953 roku autorzy postulowali, że każda para A=T i G=C połączona jest dwoma wiązaniami wodorowymi, tymczasem trzy lata później Pauling i Corey wykazali obecność trzech wiązań wodorowych miedzy G i C.
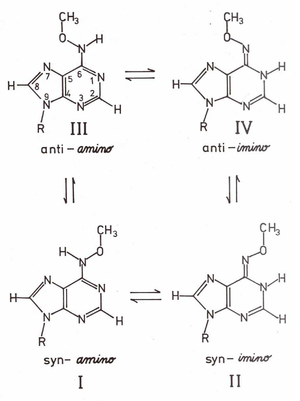
Komplementarność miedzy zasadami kwasów nukleinowych może być zakłócona przez modyfikacje chemiczne zasad, które są wywołane przez środowiskowe mutageny chemiczne pochodzące z zanieczyszczeń. Przykładem takiej modyfikacji jest N6-metoxyadenozyna (OMe6A, Schemat Figure 1), produkt reakcji (transaminacji) adenozyny (A) z mutagenem chemicznym metoxyaminą (NH2OCH3). OMe6A jest promutagenem w różnych układach prokariotycznych i eukariotycznych, np. w drożdżach, Escherichia coli, Neurospora crassa oraz fibroblastach chomika. Promutagenne własności tego analogu są także potwierdzone in vitro poprzez jego dualną funkcjonalność w układach polimeraz RNA i DNA, gdzie OMe6A zachowuje jak A lub G. Dualne własności funkcjonalne OMe6A w tworzeniu par komplementarnych z niemodyfikowanymi zasadami kwasów nukleinowych odzwierciedlone są w jej równowadze tautomerycznej amino — imino (Schemat Figure 1), gdzie grupa N6-OCH3 znajduje się w konformacji syn względem azotu N(1) pierścienia puryny. Równowaga tautomeryczna silnie zależy od środowiska (rozpuszczalnika) i zmienia się od ~90% zawartości formy aminowej w czterochlorku węgla do ~90% formy iminowej w środowisku wodnym. Ma ona kluczowe znaczenie dla tworzenia błędnej pary (ang. miss-pairing) z potencjalnie komplementarną C oraz molekularnego mechanizmu powstawania mutacji punktowych typu tranzycji A → G wywołanej obecnością OMe6A w mutagenezie środowiskowej indukowanej metoxyaminą.
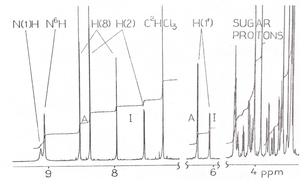
Pierwszy wariant ćwiczenia dotyczy wyznaczenia selektywnej asocjacji i stałych autoasocjacji amino-OMe6A, imino-OMe6A i C oraz heteroasocjacji OMe6A:C za pomocą spektroskopii magnetycznego rezonansu jądrowego jądra 1H (ang. 1H Nuclear Magnetic Resonace, 1H NMR). Spektroskopia 1H NMR bardzo dobrze nadaje się do zbadania równowagi tautomerycznej amino-iminowej oraz asocjacji z udziałem wiązań wodorowych, ponieważ w każdym z tych zjawisk atom wodoru 1H znajduje się w zmiennym otoczeniu chemicznym wpływającym na własności sygnału rezonansowego. Równowaga tautomeryczna jest odzwierciedlona w formie dwóch zestawów sygnałów 1H NMR o stałej proporcji między integralnymi natężeniami względnymi odpowiadającej populacji poszczególnych tautomerów (Rysunek Figure 2). Natomiast tworzeniu wiązań wodorowych z udziałem grup =N(1)-H lub =N6-H w tautomerach odpowiednio imino- OMe6A lub amino-OMe6A oraz grypy aminowej -NH2 w C powinno towarzyszyć przesuniecie sygnału rezonansowego 1H NMR.
Wymagania dotyczące kolokwium wstępnego
- Warunkiem przystąpienia do części eksperymentalnej ćwiczenia jest zaliczenie kolokwium wstępnego. Wybór sposobu przeprowadzenia kolokwium wstępnego tj. forma pisemna czy ustna, pytania otwarte czy zamknięte — należy do prowadzącego ćwiczenie.
- Materiał z zakresu spektroskopii NMR obowiązujący w czasie kolokwium wstępnego i wykonywania ćwiczenia, przedstawiony został podczas wykładów „Spektroskopia molekularna” i „Fizyka atomów, cząsteczek i makrocząsteczek biologicznych”, a pewne jego rozszerzenie bądź ilustracja konkretnych zagadnień szczegółowych zawarta jest w dołączonych do opisu publikacjach (patrz poniżej). Chętnym pragnącym poszerzyć wiedzę nt. zastosowania spektroskopii NMR polecamy następującą pozycję literaturową: W. Zieliński i A. Rajca „Metody spektroskopowe i ich zastosowanie do identyfikacji związków organicznych”(praca zbiorowa).
Publikacje dotycząca ćwiczenia:
- R. Stolarski, B. Kierdaszuk, C-E Hagberg, D. Shugar, Hydroxylamine and Methoxyamine Mutagenesis: Displacement of the Tautomeric Equilibrium of the Promutagen N6-Methoxyadenosine by Complementary Base Pairing. Biochemistry 23, 2906-13 (1984)
- R. Stolarski, B. Kierdaszuk, C-E Hagberg, D. Shugar, Mechanism of Hydroxylamine Mutagenesis: Tautomeric Shifts and Proton Exchange between the Promutagen N6-Methoxyadenosine and Cytidine. Biochemistry 26, 4332-4337 (1987)
Zagadnienia, które mogą pojawić się podczas kolokwium wstępnego:
- Na czym polega komplementarność zasad kwasów nukleinowych?
- Dlaczego komplementarne są A-U (A-T) i G-C, ale nie są komplementarne A-G, A-C i G-U(G-T)
- Jak powstają kompleksy zasad kwasów nukleinowych? Jaki jest rozkład przestrzenny zasad w kompleksach?
- Na czy polega równowaga tautomeryczna w przypadku zasad kwasów nukleinowych?
- Narysuj jedną z zasad kwasów nukleinowych i omów jej formy tautomeryczne? Która z tych form jest formą naturalną?
- Omów znane Ci oddziaływanie międzycząsteczkowe występujące w kompleksach zasad kwasów nukleinowych. Jakie atomy i ładunki uczestniczą w tych oddziaływaniach? Jaką rolę odgrywa rozkład ładunku elektronowego?
- Wymień parametry widm NMR i zastanów się które z nich zależą od równowagi tautomerycznej. Jak można zidentyfikować strukturę form tautomerycznych w roztworze? Czy równowaga tautomeryczna zależy od rozpuszczalnika?
- Jakie parametry opisujące asocjacje można otrzymać za pomocą spektroskopii NMR
Materiały
Syntezy pochodnych 2’,3’,5’-tri-O-metylo N6-metoxyadenozyny (OMe6A) i 2’,3’,5’-tri-O-etylocytydyny (C) wykonano w Zakładzie Biofizyki. Metanol, deuterowany chloroform (C2HCl3) i tetrametylosilan (Me4Si) zakupiono w firmie Merck (Niemcy).
Pomiar widm
Pomiary widm 1H NMR zostały wykonane dla roztworu 25 ml metanolu w 1 ml deuterowanego chloroformu (C2HCl3) i następujących jego rozcieńczeń (6x, 20x, 40x 100x, 200x, 600x). Ponadto wykonano pomiary widm 1H NMR pochodnej 2’,3’,5’-tri-O-metylo N6-metoxyadenozyny (OMe6A) i 2’,3’,5’-tri-O-etylocytydyny (C) swobodnych i w mieszaninach ekwimolarnych (1:1) w tych samych stężeniach w zakresie 0.005 — 0.2 M. Wszystkie widma zmierzone zostały w 20 °C dla roztworów w bezwodnym, deuterowanym chloroformie (C2HCl3) względem wewnętrznego odniesienia Me4Si.
Wyznaczenie stałych autoasocjacji i heteroasocjacji
Stała autoasocjacji [math](K_a)\;[/math] dla reakcji X + X ⇔ XX jest zdefiniowana w następujący sposób:
- [math]K_a = \frac{C_{XX}}{C_{X^2}}\;[/math],
gdzie [math]X = \text{C}[/math], amino-OMe6A lub imino-OMe6A.
Stała heteroasocjacji [math](K_a*)\;[/math] dla reakcji X + Y ⇔ XY jest zdefiniowana w następujący sposób
- [math]K_a* = \frac{C_{X}}{C_XC_Y}\;[/math],
gdzie [math]XY =\;[/math] C:OMe6A, tj. amino-OMe6A:C lub imino-OMe6A:C.
Warto pokazać, że
- [math]K_a = \frac{(\delta_m - \delta_X) (\delta_{XX} - \delta_X)}{(2Co_X(\delta_{XX} - \delta_m)^2) }\;[/math]
oraz
- [math]K_a* = \frac{(\delta_m - \delta_X) (\delta_{XX} - \delta_X)}{(CoX(\delta_{XY} - \delta_m))}\;[/math],
gdzie [math]\delta_m\;[/math] jest wielkością obserwowanego (zmierzonego) przesunięcia chemicznego; [math]\delta_X,\ \delta_{XX}\ \text{i}\ \delta_{XY}\;[/math] są wartościami granicznymi przesunięć chemicznych wyznaczonych dla [math]X,\ XX\ \text{i}\ XY\;[/math]; [math]Co_X\;[/math] jest wartością całkowitego stężenia [math]X = \text{C}\;[/math], amino-OMe6A lub imino-OMe6A (dla prawidłowego wyniku stężenia tautomerów należy skorygować zgodnie z populacja form tautomerycznych); [math]C_X,\ C_{XX},\ C_{Y}\ \text{i}\ C_{XY}\;[/math] są wartościami stężenia [math]X,\ XX,\ Y\ \text{i}\ XY\;[/math].
Z powodu znikania sygnału 1H NMR grupy aminowej w C i grupy N6-H w formie amino-OMe6A w wyniku zjawiska wymiany protonów w temperaturach powyżej -30°C pomiary zostały wykonane w temperaturze -40°C.
Wyniki
- Wykonać rysunki zależności wartości przesunięć chemicznych odpowiednich atomów wodoru w amino-OMe6A, imino-OMe6A i C od stężenia form tautomerycznych OMe6A i C, swobodnych i w mieszaninach.
- Wyznaczyć stałe autoasocjacji amino-OMe6A, imino-OMe6A i C oraz heteroasocjacji OMe6A:C.
- Wykonać analizę selektywnej heteroasocjacji C z formami tautomerycznymi OMe6A.
- Określić pochodzenie poszczególnych sygnałów 1H NMR w widmach metanolu w chloroformie? Dlaczego niezależnie od stężenia, niektóre z tych sygnałów są otoczone dwoma słabymi pikami lub rozszczepione są na multiplety?
- Dlaczego sygnały multipletowe wraz ze zmniejszaniem się stężenia metanolu wyostrzają się?
- Porównać natężenia integralne pików i wyjaśnić o czym one świadczą?
- Wykonać tabelkę i wykres zależności wartości przesunięcia chemicznego wodoru grupy OH w metanolu od jego stężenia. Zinterpretować tę zależność.