CHEM:Chemia organiczna/Etery
Budowa i nazewnictwo eterów
Eterami nazywa się związki organiczne, w których atom tlenu związany jest z dwiema resztami węglowodorowymi, nie wyłączając grup aromatycznych. Etery o nieskomplikowanej budowie nazywa się w sposób opisowy, jak podano niżej na Rys. Figure 1. Nazewnictwo systematyczne eterów traktuje grupy —OR jako podstawniki (tzn. obecność danego ugrupowania zaznacza się tylko w formie przedrostka). Ich nazwy wywodzi się od węglowodorów macierzystych z końcówką –oksy, np.: grupa OCH3 – metoksy, grupa OCH2CH3 – etoksy, grupa OC6H5 – fenoksy, itp. Nazwy systematyczne stosuje się dla eterów o bardziej skomplikowanej budowie. Przykłady podane są poniżej na Rysunku Figure 2.
| CH3—O—CH3 | eter dimetylowy |
| CH2=CH—O—CH3 | eter winylowo-metylowy |
| CH3—O—C(CH3)3 | eter metylowo-t-butylowy |
| C6H5—O—C6H5 | eter difenylowy |
| CH3CH2—O—CH2CH2Cl | 1-etoksy-2-chloroetan |
| 1,3-dimetoksypropan-2-ol |
Do eterów zalicza się też związki cykliczne z atomem tlenu jako członem pierścienia. Dla tych związków stosuje się nazwy specjalne. Przykłady eterów cyklicznych podaje poniżej Rys. Figure 3.
| wzór | nazwa |
|---|---|
| oksiran (tlenek etylenu) | |
| oksetan | |
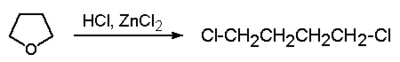
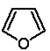
| oksolan (tetrahydrofuran) | |
|
furan |
|
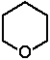
oksan (tetrahydropiran) |
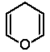
|
4H-piran |
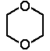
|
1,4-dioksan |
Atom tlenu jest bardziej elektroujemny od węgla i ponadto zawiera dwie wolne pary elektronowe, co przy nieliniowej budowie eterów (hybrydyzacja atomu tlenu jest typu [math]sp^3[/math]) powoduje występowanie pewnego momentu dipolowego w cząsteczkach eterów. Etery nie tworzą wiązań wodorowych z uwagi na brak atomu wodoru związanego z heteroatomem, wykazują więc dużo niższą temperaturę wrzenia niż izomeryczne alkohole. Poniższa Tabela Figure 4. ilustruje te proste zależności we właściwościach fizycznych:
| wzór | temp. wrzenia | wzór | temp. wrzenia |
|---|---|---|---|
| CH3—O—CH3 | -24°C | C2H5—O—C2H5 | 35°C |
| CH3CH2CH3 | -42°C | CH3(CH2)3CH3 | 36°C |
| CH3CH2OH | 78°C | CH3(CH2)2CH2OH | 118°C |
Międzycząsteczkowe oddziaływania dipol-dipol uwidaczniają się w eterze dimetylowym, dlatego wykazuje on wyższą temperaturę wrzenia od zbliżonego do niego pod względem budowy przestrzennej i masy molowej propanu. Dla wyższych eterów w porównaniu z odpowiednimi alkanami analogiczne różnice nie występują, bowiem oddziaływania hydrofobowe (dyspersyjne) zaczynają w nich przeważać.
Właściwości chemiczne eterów.
Wiązanie O—C w eterach jest znacznie mniej podatne na rozerwanie w porównaniu z wiązaniem O—R i O—H w alkoholach, przeto etery są mniej reaktywne od alkoholi i fenoli. Mała reaktywność eterów zbliża je raczej pod względem właściwości chemicznych do alkanów. Rozerwanie wiązania O—C może nastąpić pod działaniem silnych kwasów takich jak jodowodorowy (HI) lub stężony bromowodorowy (HBr). Zapisy takich reakcji pokazane są na Rys Figure 5. Są to reakcje substytucji nukleofilowej, w których w pierwszym etapie następuje przykoordynowanie protonu do wolnej pary elektronowej atomu tlenu z utworzeniem jonu oksoniowego, a następnie atak silnego nukleofila jakim jest anion jodkowy (lub bromkowy).
Rozszczepienie eterów pod działaniem kwasu jodowodorowego.
- R—O—R + HI —→ R—O—H + R—I
- R—O—R + 2HI —→ 2R—I + H2O
- Ar—O—R + HI —→ Ar—OH + R—I
Etery cykliczne ulegają rozszczepieniu w nieco łagodniejszych warunkach. Odpowiedni przykład jest pokazany na poniższym Rys. Figure 6.:
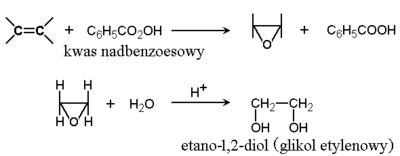
Wyjątkiem wśród eterów są pochodne oksiranu zwierające pierścień trójczłonowy, podobnie jak wyjątkiem wśród cykloalkanów są pochodne cyklopropanu. Pochodne te, zwane również epoksydami, mają duże znaczenie w syntezie organicznej. Stosunkowo łatwo jest je otrzymać z alkenów, łatwo też ulegają rozszczepieniu pod wpływem różnych odczynników. A więc służą do wprowadzania różnych grup funkcyjnych do łańcuchów węglowodorowych. Przykładowe reakcje otrzymywania i reakcji oksiranu pokazane są poniżej na Rys. Figure 7.: