Chemia/Węglowce
Z Brain-wiki
|
|
|
|
| Grafit
|
Diament
|
Fuleren60
|
|
|
|
|
| Krzem
|
German
|
Ołów
|
Stopnie utlenienia
- W stanie podstawowym węglowce mają konfigurację [math]ns^2p^2[/math]. Wykazują tendencje zarówno do oddawania jak i przyjmowania elektronów.
- Obecność 4 elektronów walencyjnych powoduje, że węglowce uzyskują trwałą konfigurację elektronową w wyniku utworzenia 4 kowalencyjnych wiązań przy udziale orbitali zhybrydyzowanych (typ hybrydyzacji [math]sp^3[/math]).
- Większą liczbę wiązań kowalencyjnych tworzą pozostałe pierwiastki 14 grupy, ponieważ mają wolne orbitale typu d w powłoce walencyjnej (związki kompleksowe Si, Ge, Sn, Pb).
- W miarę przechodzenia w dół grupy stopień utlenienia +4 staje się coraz mniej trwały a zwiększa się trwałość stopnia utlenienia +2, ponieważ para elektronowa ns2 w miarę wzrostu liczby atomowej staje się coraz bardziej bierną parą elektronową, nie biorącą udziału w tworzeniu wiązań chemicznych.
- Ze względu na niskie wartości elektroujemności węglowce nie tworzą jonów ujemnych M4-.
Właściwości fizyczne węgla
- Węgiel występuje w stanie wolnym w postaci dwóch minerałów: diamentu i grafitu różniących się budową sieci przestrzennej.
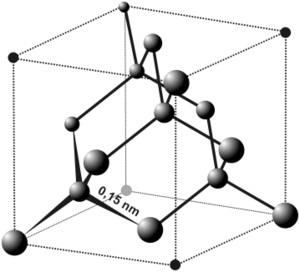
- Diament w stanie czystym tworzy przezroczyste, bardzo twarde kryształy silnie łamiące światło, nie przewodzące prądu elektrycznego. O twardości diamentu decyduje wysoka energia wiązań kowalencyjnych (83,1 kcal/mol) w sieci przestrzennej. Orbitale biorące udział w wiązaniu atomów węgla w graficie są orbitalami zhybrydyzowanymi, typu [math]sp^3[/math].
- Ogrzewany bez dostępu powietrza w temperaturze powyżej 1500°C diament przechodzi w grafit (reakcja w odwrotnym kierunku przebiega znacznie trudniej, wymaga temperatury 4000°C i ciśnienia rzędu 200 000 atm).
- Diament wykazuje bardzo słabą aktywność chemiczną. W powietrzu spala się powoli w temperaturze powyżej 800°C. Nie ulega działaniu kwasów ani zasad. Reaguje ze stopionymi solami: KNO3 oraz Na2CO3.
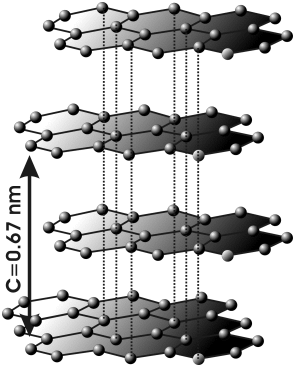
- Grafit jest miękkim minerałem, o połysku metalicznym, dobrze przewodzącym prąd elektryczny i ciepło.
- Sieć przestrzenna grafitu składa się z równoległych warstw, w obrębie których atomy węgla wykazują liczbę koordynacyjną 3 (hybrydyzacja typu [math]sp^2[/math]). Odstęp pomiędzy warstwami w sieci grafitu wynosi 3,35 Å i jest ponad dwukrotnie większy niż odległości między atomami węgla w obrębie warstw. Pomiędzy warstwami działają zatem znacznie słabsze siły niż w obrębie warstw. Dzięki słabemu powiązaniu warstw grafit jest minerałem łatwo łupliwym.
- Podobnie jak diament, grafit wykazuje małą aktywność chemiczną. W powietrzu zaczyna się spalać w temperaturze 700°C.
- Grafit tworzy szereg połączeń, w których zostaje zachowana warstwowa struktura sieci przestrzennej. Przykładem tego rodzaju połączeń są produkty działania fluoru na grafit o strukturze [math]\left(\mathrm C_4\mathrm F\right)_n[/math], w których warstwy węglowe są oddalone od siebie o 5,34 Å, co przypisuje się rozmieszczeniu atomów fluoru pomiędzy warstwami węglowymi. Połączenia grafitu z potasem (C8K) powodują wzrost przewodnictwa elektrycznego.
|
|
|
| Struktura diamentu
|
Struktura grafitu
|
|
|
|
| Fulleren60
|
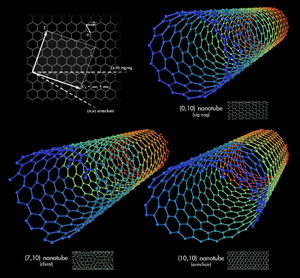
Nanorurka
|
Związki węgla i krzemu z wodorem
- Największą grupę związków węgla z wodorem stanowią węglowodory ze względu na możliwość tworzenie długich łańcuchów węglowych.
- Krzem tworzy z wodorem związki zwane silanami o strukturze [math]\mathrm{Si}_n\mathrm H_{2n+2}\ (n \leq 6)[/math] analogicznej do alifatycznych węglowodorów nasyconych (nie wykazano istnienia krzemowodorów pierścieniowych lub zawierających wiązania wielokrotne)
- Krzemowodory powstają w reakcjach chlorków krzemu z glinowodorkiem litu LiAlH4 rozpuszczonym w eterze:
- SiCl4 + LiAlH4 → SiH4 + LiCl + AlCl3
- 2Si2Cl6 + 3LiAlH4 → Si2H6 + 3LiCl + 3AlCl3.
- SiH4 oraz Si2H6 są gazami, pozostałe krzemowodory są lotnymi cieczami.
- Krzemowodory są stabilne w roztworach kwaśnych i obojętnych, natomiast w roztworach alkalicznych ulegają hydrolizie, w wyniku której powstaje uwodniona krzemionka i wodór:
- SiH4 + (n+2)H2O → SiO2∙nH2O + 4 H2.
Związki węgla i krzemu z fluorowcami
- Węgiel tworzy ze wszystkimi fluorowcami związki typu CX4 (halogenkowe pochodne metanu).
- Fluorki węgla o wzorze ogólnym [math]\mathrm C_n\mathrm F_{2n+2} \ (2 \leq n \leq 7)[/math] stanowią odpowiedniki węglowodorów nasyconych i charakteryzują się dużą odpornością chemiczną.
- Krzem tworzy z fluorowcami związki typu SiX4 oraz Si2X6.
- SiF4 można otrzymać w reakcji krzemianów z kwasem fluorowodorowym
- CaSiO3 + 6HF → CaF2 + SiF4 + 3H2O.
- SiF4 jest bezbarwnym gazem o drażniącym zapachu. W zetknięciu z wodą ulega hydrolizie:
- SiF4 + (n+2)H2O → SiO2∙nH2O + 4HF.
Związki węgla i krzemu z tlenem
- Tlenek węgla CO jest toksycznym gazem powstającym w wyniku spalania węgla w niedostatecznej ilości tlenu. Na skalę przemysłową otrzymuje się go w reakcjach:
- CH4 + H2O ⇔ CO + 3H2
- CO2 + H2 → CO + H2O
- Ditlenek węgla CO2 otrzymuje się w reakcji spalania węgla w nadmiarze tlenu:
- C + O2 → CO2
- Tlenek krzemu SiO pojawia się w fazie gazowej podczas ogrzewania mieszaniny SiO2 i węgla w temperaturze 1200-1300°C. Gaz ten ulega kondensacji dając ciało stałe o składzie SiO uważane za mieszaninę SiO2 i Si (produkt dysproporcjonacji SiO).
- Ditlenek krzemu SiO2 jest minerałem rozpowszechnionym w przyrodzie (występuje najczęściej jako kwarc-najbardziej powszechna postać krystaliczna). Stopiony SiO2 podczas szybkiego oziębiania zastyga jako bezpostaciowa masa, szkło kwarcowe. Kwarc oraz inne odmiany SiO2 są bardzo odporne chemicznie. Nie reagują z żadnym kwasem oprócz HF.
Kwasy węglowe i krzemowe
- Kwas węglowy powstaje w reakcji ditlenku węgla z wodą:
- CO2 + H2O → H2CO3.
- Kwas węglowy jest nietrwały, można go otrzymać w niskich stężeniach. Znacznie trwalsze są jego sole, węglany. Spośród węglanów obojętnych rozpuszczają się tylko węglany litowców ulegając hydrolizie:
- M2CO3 → 2M+ + CO32-,
- CO32¯ + H2O → HCO3¯ + OH¯.
- Wodorowęglany metali jedno i dwuwartościowych są dobrze rozpuszczalne w wodzie.
- Kwasy krzemowe otrzymuje się w reakcji hydrolizy krzemianów otrzymywanych w wyniku stapiania SiO2 z wodorotlenkami:
- SiO2 + 4NaOH → Na4SiO4 + 2H2O,
- Na4SiO4 + 4H2O → H4SiO4 + 4NaOH.
- H4SiO4 (kwas ortokrzemowy) ulega kondensacji z utworzeniem kwasów wielokrzemowych.
Węglowce metaliczne
- German, cyna i ołów zachowują charakterystyczną dla wszystkich pierwiastków IV grupy układu okresowego zdolność do tworzenia czterech wiązań rozmieszczonych tetraedrycznie (hydrydyzacja [math]sp^3[/math]). Nigdy nie ulegają hybrydyzacji [math]sp^2[/math] ani [math]sp[/math], czym różnią się od węgla.
- W miarę przechodzenia w dół grupy para elektronowa [math]ns^2[/math] nabiera coraz bardziej charakteru biernej pary elektronowej, w związku z czym wzrasta tendencja do tworzenia jonów dwudodatnich, najsilniej zaznaczona w przypadku ołowiu.
- Ze wzrostem trwałości stopnia utlenienia +2 maleje wyraźnie trwałość stopnia utlenienia +4.
Reaktywność węglowców metalicznych
- W powietrzu, w warunkach normalnych german, cyna i ołów są trwałe. W wysokiej temperaturze german i cyna tworzą ditlenki GeO2 i SnO2, natomiast ołów daje tlenek PbO, który przechodzi w tlenek Pb3O4.
- German i cyna nie reagują z wodą, ołów reaguje powoli w obecności tlenu i CO2:
- Pb + ½ O2 + H2O → Pb(OH)2,
- Pb + ½ O2 + 2 CO2 + H2O → Pb(HCO3)2.
- Wszystkie trzy metale reagują z kwasem azotowym z wytworzeniem nierozpuszczalnego GeO2, uwodnionego SnO2 i Pb(NO3)2.
- Z mocnymi kwasami i zasadami reaguje tylko cyna:
- Sn + 2HCl → SnCl2 + H2.
- Sn + 4 H4O + 2OH¯ → [Sn(OH)6]2- + 2H2.
Związki z fluorowcami
- Wszystkie trzy metale tworzą dwa typy związków z fluorowcami: MeX4 i MeX2.
- Tetrahalogenki mają charakter kowalencyjny, podobnie jak CCl4 lub SiCl4. Wykazują budowę tetraedryczną (hybrydyzacja [math]sp3[/math]).
- Trwałość tetrahalogenków maleje w szeregu od germanu do ołowiu oraz od fluoru do jodu, w związku z czym german i cyna tworzą tetrahalogenki ze wszystkimi fluorowcami, ołów tylko z fluorem i chlorem.
- GeF4 jest w warunkach normalnych gazem, wszystkie tetrachlorki są cieczami, pozostałe tetrahalogenki łatwo topliwymi ciałami stałymi.
- Tetrahalogenki wykazują tendencje do tworzenia jonów kompleksowych w obecności nadmiaru jonów halogenkowych lub odpowiedniego kwasu halogenowodorowego:
- SnCl4 + 2HCl → H2SnCl6
- który można wydzielić z roztworu w postaci hydratu H2SnCl6∙6H2O.
- Dihalogenki germanu, cyny i ołowiu są ciałami stałymi wykazującymi wyższe temperatury topnienia niż odpowiednie tetrahalogenki, co jest wynikiem większego udziału charakteru jonowego ich wiązań.
- Rozpuszczalność dihalogenków w wodzie maleje w szeregu od germanu do ołowiu oraz od chloru do jodu. Rozpuszczalność halogenków ołowiu PbCl2, PbBr2, PbJ2 zależy od temperatury. W temperaturze pokojowej związki te są trudno rozpuszczalne, ale rozpuszczalność znacznie wzrasta ze wzrostem temperatury.
- SnCl2 jest popularnym środkiem redukującym:
- 2Fe3+ + Sn2+ → 2Fe2+ + Sn4+
- 2Hg2+ + Sn2+ → Hg22+ + Sn4+
Tlenki i wodorotlenki metali grupy 14
- German, cyna i ołów tworzą tlenki MeO oraz ditlenki MeO2. Ołów tworzy ponadto tlenek Pb3O4.
- W szeregu tlenków: GeO, SnO, i PbO obserwuje się słabnącą tendencję do dalszego utleniania. Dwa pierwsze tlenki ogrzewane w atmosferze powietrza przechodzą w ditlenki. PbO nie ulega dalszemu utlenieniu.
- Żaden z tlenków nie reaguje z wodą. Wodorotlenki germanu, cyny i ołowiu uzyskuje się w reakcjach soli z mocnymi zasadami:
- SnCl2 + 2NaOH → Sn(OH)2 + 2Na+ + 2Cl¯,
- Pb(CH3COO)2 + 2NaOH → Pb(OH)2 + 2Na+ + 2CH3OO¯.
- Oba wodorotlenki wykazują własności amfoteryczne: w reakcjach z kwasami tworzą sole, a w reakcjach z zasadami hydroksycyniany lub hydroksyołowiany
- Sn(OH)2 + NaOH → Na[Sn(OH)3] — trihydroksycynian (IV) sodu.
- GeO2 słabo rozpuszcza się w wodzie, a odczyn roztworu jest kwaśny w wyniku pojawienia się słabych kwasów germanowych:
- GeO2 + H2O → H2GeO3 — kwas metagermanowy,
- GeO2 + 2 H2O → H4GeO4 — kwas ortogermanowy.
- GeO2 jest trudno rozpuszczalny w kwasach, ale łatwo rozpuszcza się w mocnych zasadach dając germaniany:
- GeO2 + 2NaOH → Na2GeO3 + H2O.
- SnO2 nie rozpuszcza się w wodzie i nie ulega działaniu kwasów i zasad. Stapianie SnO2 z NaOH prowadzi do otrzymania bezwodnego cynianu:
- SnO2 + NaOH → Na2SnO3.
- PbO2 rozpuszcza się w stężonym kwasie octowym i stężonym NaOH:
- PbO2 + 4CH3COOH → Pb(CH3COO)4 + 2 H2O,
- PbO2 + 2NaOH + 2 H2O→ Na2[Pb(OH)6] — heksahydroksyołowian (IV) sodu.