Chemia organiczna/Cykloalkany
W poprzednim rozdziale zostało wspomniane, że atomy węgla mogą tworzyć nie tylko układy łańcuchowe, ale również łączyć się w pierścienie. Jeżeli węglowodór zawiera układ cykliczny, to jego wzór sumaryczny przybiera formę [math]\mathrm C_n\mathrm H_{2n}[/math]. Ogólnie takie związki nazywa się cykloalkanami. Poniżej podane są wzory, nazwy i temperatury wrzenia najprostszych przedstawicieli tej grupy związków:
| wzór | nazwa | temp. wrzenia [°C] |
|---|---|---|
| cyklopropan | -33 | |
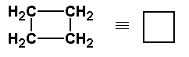
|
cyklobutan | 13 |
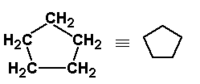
|
cyklopentan | 49 |
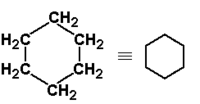
|
cykloheksan | 81 |
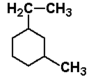
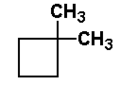
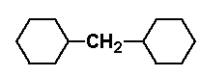
Zauważmy, że cykloalkany nie są izomerami alkanów, chociaż zawierają tak jak one tylko pojedyncze wiązania między atomami składowymi. W piśmie wzory cykloalkanów najczęściej upraszcza się do postaci figur geometrycznych (tak jak pokazano na Rys. Figure 1.: trójkąt, kwadrat, pięciokąt itd.), należy jednak pamiętać, że w każdym wierzchołku takiej figury znajduje się atom węgla (nierozgałęziony jak w przykładach powyżej, bądź rozgałęziony jak w przykładach poniżej na Rys. Figure 2.). Nazwy cykloalkanów (oraz grup cykloalkilowych od nich się wywodzących) poprzedza się przedrostkiem "cyklo-". Oczywiście, oprócz prostych cykloalkanów znane są węglowodory, w których układy cykliczne powiązane są z resztami łańcuchowymi. Przykłady takich związków wraz z ich nazwami podane są poniżej na Rys. Figure 2.:
| wzór | nazwa |
|---|---|
|
1-etylo-3-metylocykloheksan |
|
1,1-dimetylocyklobutan |
|
dicykloheksylometan |
Powyższe przykłady pokazują, że nazwy takich związków można tworzyć biorąc za podstawę węglowodór cykliczny bądź łańcuchowy, w zależności od tego która z tych nazw ma prostszą strukturę. Na przykład alternatywną nazwą dicykloheksylometanu mógłby być (cykloheksylometylo)-cykloheksan, ale byłaby to nazwa bardziej skomplikowana i mniej czytelna.
W przypadku cykloalkanów zawierających dwa lub więcej podstawników przy pierścieniu pojawia się nowy rodzaj izomerii, niespotykany w alkanach. Dwa podstawniki w układzie cyklicznym mogą wystąpić po tej samej stronie pierścienia lub być skierowane w strony przeciwne. Oba takie związki mają taki sam wzór sumaryczny, taki sam układ cykliczny i dwa takie same podstawniki przy tych samych atomach węgla, ale są izomerami ze względu na różne usytuowanie przestrzenne podstawników. Najprostszy przykład podaje poniżej Rys. Figure 3.:
W normalnych warunkach (bez rozerwania wiązania C—C) swobodna rotacja wokół pierścieniowych wiązań C—C jest niemożliwa, tak że oba izomery cis i trans nie mogą wzajemnie w siebie przechodzić. Są one innymi związkami różniącymi się właściwościami fizycznymi i chemicznymi. Tego typu izomeria wchodzi w zakres szerszego pojęcia stereoizomerii (a nie izomerii konstytucyjnej) i bywa zwana izomerią cis-trans lub geometryczną. W przypadku istnienia izomerów geometrycznych pełna nazwa związku powinna zawierać przedrostek cis lub trans. I tak np. w przypadku pierwszego z lewa wzoru na Rys. Figure 2. nazwa 1-etylo-3-metylocykloheksan jest niepełna, gdyż nie precyzuje z którym izomerem, cis czy trans, mamy do czynienia.
Zauważmy również, że na Rys. Figure 3. zastosowano inny rodzaj wzoru perspektywicznego, w którym na pierścień związku patrzymy z boku, przy czym dla zaznaczenia efektu perspektywy wiązanie frontalne jest pogrubione. Takie wzory zwiemy wzorami Hawortha i będziemy je wykorzystywać w dalszej części tego opracowania.
Właściwości chemiczne cykloalkanów
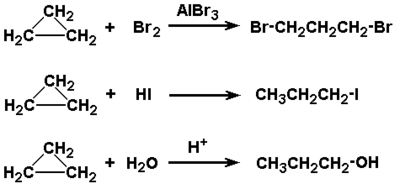
Cykloalkany pod względem reaktywności chemicznej są podobne do alkanów. Są bierne wobec odczynników jonowych, natomiast reagują w odpowiednich warunkach z odczynnikami działającymi według mechanizmu wolnorodnikowego. Do wyjątków należy cyklopropan, najprostszy przedstawiciel tej klasy związków. Jest on związkiem znacznie reaktywniejszym, co upodabnia go bardziej do węglowodorów nienasyconych, o których będzie mowa w następnym rozdziale, niż do alkanów. Charakterystyczną reakcją cyklopropanu jest rozrywanie pierścienia pod działaniem odczynników o charakterze kwasowym. Przykładowe reakcje cyklopropanu pokazane są na Rys. Figure 4. Większą reaktywność cyklopropanu tłumaczy obrazowo Rys. Figure 5. Wiązania C—C w cyklopropanie są słabsze niż w alkanach i innych cykloalkanach, gdyż tworzące je orbitale [math]sp^3[/math] atomów węgla nie mogą nakrywać się efektywnie.
W świetle tego obrazu zrozumiała jest też podatność pierścienia trójwęglowego na atak odczynników o charakterze elektrododatnim (czyli kwasowym). Elektrony wiązania C—C są eksponowane na zewnątrz pierścienia i łatwo wchodzą w oddziaływanie z elementami elektrododatnimi.
Mimo tej większej reaktywności pierścienia cyklopropanowego, jest on na tyle trwały, że występuje w wielu związkach naturalnych.
Konformacje cykloalkanów
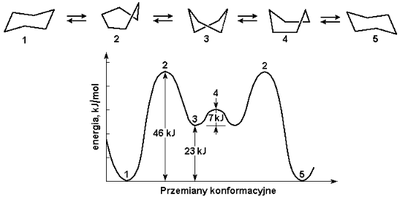
Pierścienie węglowe cykloalkanów, z wyjątkiem cyklopropanu, nie są układami płaskimi. Cyklobutan i cyklopentan mogłyby tworzyć teoretycznie układy płaskie, ponieważ wtedy formalne odchylenia kątów wiązań C—C—C od kąta 109,5° byłyby najmniejsze, ale w takiej konformacji (naprzeciwległej) występuje najsilniejsze odpychanie pomiędzy atomami wodoru przy sąsiednich atomach węgla (por. wzory Newmana na Rysunkach 7. i 8. w poprzednim rozdziale). Sytuację kompromisową pod względem energii wewnętrznej w tych związkach stanowi pofałdowanie pierścienia. W pierścieniach cykloheksanu i większych, grupy CH2 układają się w przestrzeni tak, aby zachowywać kąty wiązań 109,5°, charakterystyczne dla atomów węgla o hybrydyzacji [math]sp^3[/math], i równocześnie tak, aby atomy wodoru były maksymalnie od siebie oddalone. Rys. Figure 6. przedstawia profil energii wewnętrznej dla różnych konformacji cykloheksanu. Konformacje oznaczone na tym rysunku cyframi 1 i 5 zwane są krzesłowymi i są najkorzystniejsze pod względem energetycznym. W tych konformacjach atomy wodoru wokół każdego wiązania C—C przyjmują położenie naprzemianległe. W innych konformerach, które występują tylko w stanach pośrednich podczas przejść konformacyjnych od jednej formy krzesłowej do drugiej (łódkowa — 4, skręcona łódkowa — 3 i półkrzesłowa — 2), pojawiają się oddziaływania naprzeciwległe pomiędzy atomami wodoru, powodując wzrost energii wewnętrznej danego układu.
Bariera energetyczna przejść konformacyjnych cykloheksanu, aczkolwiek znacznie większa niż dla węglowodorów łańcuchowych, może być pokonana w temperaturze pokojowej, więc konformacje 1 i 5 mogą się wzajemnie w siebie przekształcać. Poniższy Rys. Figure 7. pokazuje wzory perspektywiczne dwu krzesłowych konformacji cykloheksanu wraz z wiązaniami C—podstawnik (w przypadku niepodstawionego cykloheksanu - C—H).
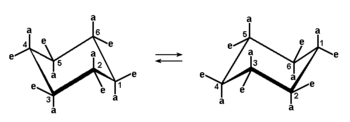
Zauważmy, że w cząsteczce cykloheksanu w jego najstabilniejszej konformacji (99,99% cząsteczek cykloheksanu w temp. pok. przybiera formę krzesłową) występują dwa rodzaje wiązań C—H, różniące się kierunkiem w przestrzeni wobec szkieletu węglowego. Wiązania oznaczone na Rys. Figure 7. literą "a" zwane są aksjalnymi (czyli osiowymi, gdyż skierowane są równolegle do trójkrotnej osi cząsteczki), a wiązania oznaczone literą "e" nazywamy ekwatorialnymi (równikowymi, leżącymi w przybliżeniu w płaszczyźnie prostopadłej do tej osi). W przypadku samego cykloheksanu to zróżnicowanie wiązań C—H nie pociąga za sobą żadnych konsekwencji fizykochemicznych z powodu równocenności obu konformerów. Podczas zmiany konformacji podstawniki aksjalne staja się ekwatorialnymi i odwrotnie. Jednak w przypadku pierścieni podstawionych występują różnice w trwałości obu konformerów krzesłowych oraz mogą pojawić się różnice w reaktywności podstawników aksjalnych i ekwatorialnych.
Jak było powiedziane poprzednio, w konformacji krzesłowej cykloheksanu wiązania przy sąsiednich atomach węgla przyjmują położenie naprzemianległe, a więc najkorzystniejsze pod względem energii wewnętrznej. Jedynym czynnikiem destabilizującym taką konformację są oddziaływania (odpychanie się wzajemne chmur elektronowych) pomiędzy podstawnikami aksjalnymi. Takie oddziaływania nazywamy 1,3-dwuaksjalnymi, jako że dotyczą podstawników usytuowanych przy drugim z kolei atomie węgla (jeżeli sąsiedni atom węgla oznaczymy jako pierwszy odległy w pierścieniu). W przypadku niepodstawionego cykloheksanu, oddziaływania po jednej i po drugiej stronie pierścienia równoważą się i w efekcie obie konformacje krzesłowe są równie prawdopodobne. W przypadku natomiast podstawionego cykloheksanu, np. metylocykloheksanu na Rys. Figure 8., oddziaływania 1,3-dwuaksjalne w konforamcji z aksjalną grupą metylową są znacznie większe, z uwagi na większą objętość podstawnika niż atomu wodoru. Dlatego konformacja z podstawnikiem ekwatorialnym (po lewej stronie na Rys. Figure 8.) jest zdecydowanie uprzywilejowana. Różnica w energii wewnętrznej pomiędzy tymi konformerami metylocykloheksanu wynosi ok. 7,6 kJ/mol, co daje w temp. pok. stosunek populacji obu konformerów ok. 95 : 5%.
Dekaliny
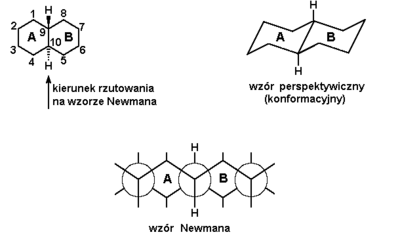
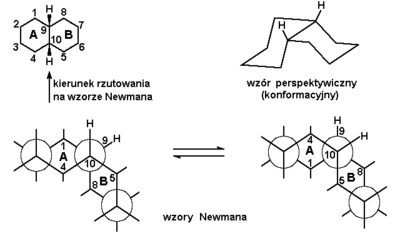
Znane są cykloalkany wielopierścieniowe, tzw. skondensowane, w których pierścienie połączone są ze sobą poprzez więcej niż jeden atom węgla. Przykładem niech będzie związek złożony z dwóch pierścieni cykloheksanu zwany dekaliną. Rozróżniamy dwa izomery tego związku: trans- i cis-dekalinę. Budowa trans-dekaliny pokazana jest na Rys. Figure 9., natomiast cis-dekaliny na Rys. Figure 10.
W trans-dekalinie atomy wodoru (wyróżnione spośród innych na rysunku) przy zwornikowych atomach węgla tworzą układ trans (znajdują się po przeciwnych stronach układu cyklicznego). Takie samo stwierdzenie dotyczy oczywiście atomów węgla 1 i 4 względem pierścienia B jak i atomów węgla 5 i 8 względem pierścienia A. Zauważmy również, że w trans-dekalinie oba pierścienie składowe położone są względem siebie równolegle (dokładniej: atomy węgla 2, 3, 6, 7, 9 i 10 leżą w jednej płaszczyźnie), a labilność konformacyjna jest bardzo ograniczona. Bowiem atomy węgla 1, 4 i 5, 8 muszą pozostawać ekwatorialne, gdyż w pozycjach aksjalnych nie mogłyby utworzyć pierścienia. Tym samym atomy wodoru w pozycjach zwornikowych są cały czas w położeniu aksjalnym (lub bardzo do niego zbliżonym). Niemożliwe jest przejście jednej konformacji krzesłowej w drugą, możliwą w układzie monocyklicznym.
W przeciwieństwie do omówionej trans-dekaliny, cis-dekalina wykazuje dużą swobodę rotacyjną. Budowę cis-dekaliny wraz z możliwościami zmian konformacyjnych w obrębie tworzących ją pierścieni pokazuje Rys. Figure 10.