FizykaII OO/Budowa atomu a promieniowanie światła
Pokazy
- Widma liniowe emisyjne: wodór, hel, neon.
- Obserwacja przez siatki dyfrakcyjne.
Długości linii światła z zakresu widzialnego dla wodoru
- [math]\unit{0,656}{\mu m}[/math]
- [math]\unit{0,486}{\mu m}[/math]
- [math]\unit{0,434}{\mu m}[/math]
- [math]\unit{0,410}{\mu m}[/math]
Wzór Rydberga i jego interpretacja
[math]\frac{1}{\lambda}=R\left(\frac{1}{k^2}-\frac{1}{n^2} \right)[/math]
Pierwszy postulat Bohra
Elektron w atomie wodoru może poruszać się tylko po ściśle określonych orbitach, zwanych orbitami stacjonarnymi, i nie emituje energii. Pierwszy postulat określa, jakie położenia elektronu są możliwe, jakie orbity są możliwe. Orbita dozwolona to taka, na której moment pędu elektronu jest równy całkowitej wielokrotności stałej Plancka podzielonej przez [math]2\pi[/math]Moment pędu jest wielkością fizyczną, której wartość dla ciała poruszającego się po okręgu jest iloczynem pędu i promienia tego okręgu. Jest to wielkość określana nie tylko dla elektronu, ale dla każdego ciała, które porusza się po zakrzywionym torze. Pierwszy postulat mówi zatem, że wartość momentu pędu elektronu jest skwantowana.
[math]mvr=n\frac{h}{2\pi},\ n=1,2,3,\ldots[/math]
gdzie: r — promień n-tej orbity, m — masa elektronu, v — prędkość elektronu.
Drugi postulat Bohra
Elektron, przechodząc z jednej orbity dozwolonej na drugą, emituje lub absorbuje kwant promieniowania elektromagnetycznego równy różnicy energii elektronu na tych dwu orbitach:
[math]h\nu =E_l-E_k[/math]
[math]E_l,\ E_k[/math] — energia na l-tej i k-tej orbicie.
[math]E = E_k+E_p[/math]
[math]E_k = \frac{mv^2}{2},[/math] [math]E_p = -k\frac{e^2}{r}[/math]
[math]E = \frac{mv^2}{2} - k\frac{e^2}{r}[/math]
[math]k= \unit{9\cdot 10^9}{\frac{Nm^2}{C^2}}[/math], e — ładunek elementarny. Siłą, która utrzymuje elektron na orbicie jest siła kulombowska. Można więc zapisać równość:
To znaczy siła dośrodkowa równa jest sile oddziaływania elektrycznego elektronu i protonu. Jednocześnie moment pędu może przyjmować ściśle określone wartości — mówimy, że moment pędu jest skwantowany:
Aby obliczyć energię na dowolnej orbicie, należy najpierw znaleźć wyrażenie na wielkość promienia orbity. Zrobimy to w ten sposób, że równanie (Equation 2) podniesiemy do kwadratu i stronami podzielimy przez równanie (Equation 1), a następnie wyliczymy [math]r_n[/math] — promień n-tej orbity
[math]r_n = n^2 \frac{h^2}{4\pi^2e^2mk},[/math]
[math]r_n\propto n^2[/math]
Promienie kolejnych orbit mają się do siebie tak, jak kwadraty kolejnych liczb naturalnych.
Z równania (Equation 1) otrzymujemy
[math]mv^2 =k\frac{e^2}{r}[/math]
i dlatego wyrażenie na energię przyjmuje postać
[math] E = \frac{ke^2}{2r}-\frac{ke^2}{r}=-\frac{ke^2}{2r}[/math]
Wstawiając obliczoną wartość promienia n-tej orbity, można zapisać, że energia na niej wynosi:
[math]E_n = -\frac{2\pi^2 k^2e^4 m}{n^2h^2}[/math]
[math] E_n \propto \frac{1}{n}[/math]
Przyjrzyjmy się, jak model Bohra "pasuje“ do rzeczywistości. Obliczmy długość fali światła wyemitowanego przy przejściu elektronu z orbity l-tej na n-tą (l>n):
[math]E_l = \frac{2\pi^2 k^2e^4 m}{l^2h^2}[/math], [math]E_n= -\frac{2\pi^2 k^2e^4 m}{n^2h^2}[/math]
Różnica energii równa kwantowi promieniowania wynosi:
[math]\Delta E =\left(\frac{1}{n^2}-\frac{1}{l^2} \right)\frac{2\pi^2 k^2e^4 m}{h^2}[/math]
[math]\Delta E = h\nu = \frac{h c}{\lambda}[/math],
[math]\frac{1}{\lambda}=\left(\frac{1}{n^2}-\frac{1}{l^2} \right)\frac{2\pi^2 k^2e^4 m}{h^3c}[/math],
Model Bohra umożliwia obliczenie wartości promienia pierwszej orbity elektronu, a przez to rozmiarów atomu wodoru. Obliczmy ją
[math]r_1=\frac{h^2}{4\pi^2e^2mk}[/math],
[math]\unit{\frac{\left(6,62\cdot 10^{-34}\right)^2}{4\pi^2\cdot 8\cdot 10^9 \cdot 9,1 \cdot 10^{-31} \left(1,6\cdot 10^{-19}\right)^2}}{m}= \unit{0,528\cdot 10^{-10}}{m}[/math]
Wartości stałych podane były w układzie SI, a więc wynik uzyskaliśmy w metrach. Promień atomu wodoru oszacowany eksperymentalnie zgadza się z tak obliczonym. Również dobrą zgodność teorii Bohra z doświadczeniem otrzymujemy, gdy obliczymy wartość energii elektronu w stanie podstawowym i porównamy tę wartość z doświadczalnie znalezioną energią jonizacji atomu. Energia jonizacji — to energia, jaką trzeba dostarczyć atomowi, aby wyrwać elektron z atomu. W wodorze jest jeden elektron w stanie podstawowym o energii
[math]E_1= \frac{2\pi^2 k^2e^4 m}{h^2} = \unit{\frac{2\pi^2 \left(9\cdot 10^9\right)^2\left(1,6\cdot 10^{-19}\right)^4 \cdot 9,1\cdot 10^{-31}}{\left(6,62\cdot 10^{-34}\right)^2}}{J} =\unit{-2,1758\cdot 10^{-18}}{J}[/math]
przy czym [math]\unit{2,1758\cdot 10^{-18}}{J}=\unit{13,59}{eV}[/math]. Energia jonizacji atomu wodoru.
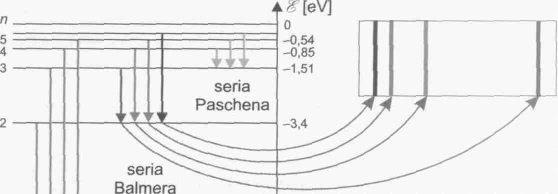
Rysunek poniżej poziomów energetycznych atomu wodoru z zaznaczeniem poszczególnych linii widmowych.