Histologia/Komórki podporowe substancja pozakomórkowa
Spis treści
MACIERZ POZAKOMÓRKOWA
jest to substancja, która wypełnia przestrzeń pomiędzy komórkami. Grube włókna kolagenu i elastyny przeplatane są strukturą substancji podstawowej zbudowanej z proteoglikanów i glikozaminoglikanów — grupy związków tworzące filtr biofizyczny i odpowiadające za hydrofilny charakter macierzy (potrafią wiązać i utrzymywać wodę). Wszystkie morfotyczne, upostaciowane składniki tkanki łącznej (komórki i włókna) zawieszone są w tejże substancji. Macierz pozakomórkowa jest swoistym tworem, który zespala komórki w tkanki i narządy, umożliwia organizację przestrzenną tkanki oraz zapewnia jej mechaniczną stabilność i podporę dla komórek (komórki bardziej przylegają do macierzy niż do sąsiadujących komórek). Macierz ta, pełniąca rolę sfery ochronnej komórek (znajdująca się między nimi a środowiskiem zewnętrznym), występuje u wszystkich organizmów wielokomórkowych. Wszelkie substancje, które chcą przedostać się do komórki (usadowionej na błonie podstawnej lub funkcjonującej z dala od innych komórek struktury), musi przedostać się przez macierz pozakomórkową. Jest ona zatem biofizycznym filtrem, który kontroluje przekazywanie składników odżywczych i produktów odpadowych, mediatorów i wszelkich innych substancji ze środowiska do komórki. Jakość struktury gwarantuje prawidłowe funkcjonowanie komórki danego narządu, dlatego jej podstawową funkcją fizjologiczną jest filtrowanie różnych substancji, które przenoszone są z naczyń włosowatych do komórki (i na odwrót). Macierz pozakomórkowa zbudowana jest w głównej mierze z kolagenu. W grupie białek niekolagenowych wyróżniamy elastynę, fibronektynę, lamininę, trombospondynę, tenascyny, matryliny, nidogen, fibulinę, fibrylinę oraz glikoproteiny zasocjowane z mikrofibrylami.
Potencjał elektryczny macierzy zewnątrzkomórkowej wynosi 240 μV i może zmieniać się w zależności od różnych parametrów (np. pH, stres, zapalenie, leki i inne).
Macierz komórkowa jest głównym miejscem gromadzenia się homotoksyn (faza depozycji) lub ich eliminacji w procesie zapalnym (faza zapalenia). Homotoksyny zaburzają w różnym stopniu funkcjonowanie komórki i mogą powodować powstanie przewlekłych chorób degeneracyjnych, których głównymi cechami są dysfunkcja i śmierć komórek. Gromadzenie dużej ilości homotoksyn w macierzy zewnątrzkomórkowej może zaburzyć płynność transportu składników odżywczych i produktów resztkowych. Macierz zewnątrzkomórkowa jest głównym miejscem działania większości procesów regulacyjnych organizmu. Ponieważ substancja zewnątrzkomórkowa jest blisko komórki, dlatego jakość życia komórki jest silnie uzależniona od czystości macierzy. Mimo, że większość toksyn występuje i gromadzi się w macierzy zewnątrzkomórkowej, ich wpływ często sięga wnętrza komórki i jądra. Dlatego nie można uznawać macierzy zewnątrzkomórkowej za izolowaną, interaktywną strukturę informacyjną, ale należy skupić się na interakcjach pomiędzy różnymi poziomami żywej macierzy.
Komórki podporowe
Macierz pozakomórkowa wytwarzana jest poprzez wysoce wyspecjalizowane komórki podporowe, do których należą:
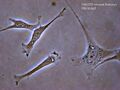
- fibroblasty — w większości tkanek; trójwymiarowa sieć, która rozciąga się pomiędzy komórką narządu a naczyniami włosowatymi i chłonnymi; syntezuje struktury proteoglikanów i glikozaminoglikanów przez aparat Golgiego; ma podstawowe znaczenie dla macierzy zewnątrzkomórkowej, gdyż odtwarzają uszkodzoną (na skutek zakażenia lub zranienia) strukturę macierzy. Posiadają zwykle rozgałęzioną cytoplazmę, otaczającą eliptyczne jądro komórkowe.
- chondrocyty — chrząstki
- osteoblasty — kości
- miofibroblasty — wytwarzają składniki substancji pozakomórkowej
- adipocyty (komórki tłuszczowe) — gromadzą lipidy
Główne składniki substancji pozakomórkowej
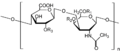
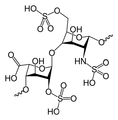
- glikozaminoglikany (GAG-i) — duże polisacharydy zbudowane z powtarzających się jednostek dwucukrowych. Jedna reszta to zawsze aminocukier (D-glukozamina lub D-glaktozamina), a druga to kwas uronowy (D-glukuronowy lub L-iduronowy). Tworzą uwodniony żel w tkankach podporowych, różnie rozmieszczony w tkankach. Niemal wszystkie GAG-i zawierają dodatkowo grupę siarczanową, nadającą cząsteczkom silny ładunek ujemny, a także przyczyniającą się do wiązania przez nie jonów sodu i wody (co nadaje tkance prężność i zapobiega deformacjom na skutek działania sił ściskających). Łączą się również z białkami tworząc proteoglikany (olbrzymie cząsteczki zdolne do wiązania w substancji pozakomórkowej dużą ilość wody). Cząsteczki proteoglikanów występujące na powierzchni komórek różnego typu:
- wiążą się, między innymi, z fibronektyną i lamininą
- pełnią rolę receptorów
- biorą udział w adhezji komórkowej oraz oddziaływaniach międzykomórkowych
- oddziałując z kolagenem i elastyną utrzymują właściwą strukturę tkanki łącznej
- zmiany jakościowe i ilościowe tych makrocząsteczek w macierzy mogą prowadzić do aktywacji niektórych onkogenów (genów nowotworów).
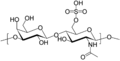
- kwas hialuronowy — jest biopolimerem, w przeciwieństwie do innych glukozoaminoglikanów nie tworzy kowalencyjnego wiązania z białkami, nie może więc wchodzić w skład typowego proteoglikanu. Może jednak stanowić oś, na której wiążą się inne proteoglikany tworząc wraz z nimi agregat proteoglikanu. Zbudowany jest z powtarzającego się dwucukru, w którego skład wchodzi kwas glukuronowy oraz N-acetyloglukozoamina. Kwas hialuronowy poprzez wiązanie i zatrzymywanie wody w przestrzeniach międzykomórkowych zwiększa odporność tkanek na stres mechaniczny. Zapewnia również tkance sprężystość i wytrzymałość. Pochodne tego kwasu stosuje się do zwiększania objętoci tkanek miękkich na drodze podskórnych iniekcji. Ponieważ kwas ten wiąże wodę w naskórku (co gwarantuje skórze sprężystość), w starszych organizmach, gdy ilość kwasu maleje, skóra traci zdolność wiązania wody i powstają zmarszczki. Substancje zawierające kwas hialuronowy charakteryzują się wysoką lepkością, co utrudnia przenikanie przez nie czynników patogennych (np. bakterii), dzięki czemu tkani chronione są przed infekcją. Z tego względu jego niedobór może prowadzić do podatności na infekcje bakteryjne, stany zapalne stawów oraz mechaniczne uszkodzenia tkanek. Rozmieszczenie: chrząstka, maź stawowa, skóra, tkanka podporowa
- siarczan chondroityny i dermatanu — rozmieszczenie: skóra, chrząstka, kość, tkanka podporowa, naczynia krwionośne, serce
- siarczan chondroityny (A i C) zbudowany jest z około 25-40 powtarzających się jednostek dwucukru (kwas glukuronowy oraz N-acetylogalaktozoamina), przy czym reszta N-acetylogalaktozoaminy może ulegać podstawieniu siarczanem w pozycji 4 lub 6. Siarczan ten połączony z kwasem hialuronowym za pomocą białek wiążących utrzymuje właściwą strukturę, sprężystość i wytrzymałość tkanki chrzęstnej. Rozwój zmian zwyrodnieniowych u osób starszych związany jest ze zmniejszaniem się jego zawartości w chrząstce.
- siarczan dermatanu (dawniej siarczan chondroityny B) zamiast kwasu D-glukuronowego występującego w siarczanie chondroityny, związanego z N-acetylogalaktozoamią wiązaniem beta 1,3, posiada kwas L-iduronowy połączony wiązaniem alfa 1,3. Obecny jest w rogówce oka (zapewniając jej przezroczystość) oraz w twardówce (gdzie odpowiedzialny jest za utrzymanie właściwego kształtu gałek ocznych)
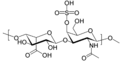
- siarczan heparanu i heparyna — rozmieszczenie: błona podstawna, tętnice płucne, płuco, skóra, wątroba, ziarna komórek tucznych
- siarczan heparanu zbudowany jest z monomerów kwasu D-glukuronowego oraz N-acetyloglukozoaminy, przy czym reszty N-acetyloglukozoaminy mogą być podstawiane kilkoma grupami siarczanowymi. Zadania: uczestniczy w oddziaływaniach między komórkami, odpowiada za sprężystość bony plazmatycznej a także przejmuje funkcje receptorową (a więc bierze udział w przenoszeniu informacji). Organizmy takie jak wirus Denguea, wirusy herpes (HSV 1), sporozoity malarii czy dwoinki rzeżączki wykorzystują siarczan heparanu obecny na powierzchni komórek jako receptor podczas wiązania się do komórek gospodarza (Liu J., Thorp S. C.: Cell surface heparan sulfate and its roles in assisting viral infections. Med. Res. Rev. 2002, 22, 1-25)
- heparyna zbudowana jest z powtarzającej się sekwencji disacharydu (glukozoaminy oraz kwasu glukuronowego). Występuje głównie w ziarnistociach komórek tucznych, wątrobie, mięśniach, płucach, sercu, nerkach oraz śledzionie, a także w skórze i krwi
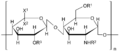
- siarczan keratanu — tutaj miejsce kwasu uronowego zajmuje galaktoza (cukier prosty, C6H12O6, nie spotykany w postaci wolnej). Zbudowany jest z powtarzających się jednostek galaktozy połączonej z N-acetyloglukozoaminą. Rozmieszczenie: rogówka, chrząstka, krążek międzykręgowy. Typy:
- typ I — N-acetyloglukozoamina łączy się wiązaniem N-glikozydowym z resztą asparaginy, występuje pomiędzy włóknami kolagenowymi nadaje przezroczystość rogówce oka
- typ II — N-acetyloglukozoamina tworzy wiązanie O-glikozydowe z resztą seryny lub treoniny. Występuje w tkance łącznej
- typ I — N-acetyloglukozoamina łączy się wiązaniem N-glikozydowym z resztą asparaginy, występuje pomiędzy włóknami kolagenowymi nadaje przezroczystość rogówce oka
- białka włókniste — decydujące o odporności tkanek na rozciąganie. Główne białka:
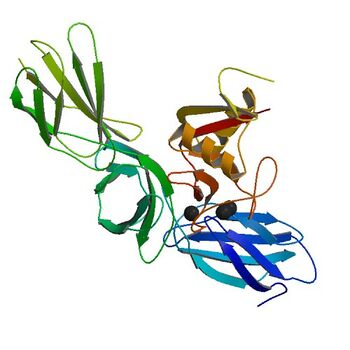
- kolagen — główne białko tkanki łącznej; jest białkiem pozakomórkowym, stanowi około 1/3 wszystkich białek ludzkiego organizmu; jest to grupa ściśle spokrewnionych białek tworzących filamenty , włókienka i sieci a następnie wiążące się z innymi białkami. Kolagen zawiera duże ilości glicyny i proliny oraz dwa aminokwasy (hydroksyprolinę — w dużych ilościach i hydroksylizynę). Aminokwasy te są formowane w procesie enzymatycznym, która wymaga obecności witaminy C (wymagana konieczność występowania stałego stężenia witaminy C w organizmie [math]\rightarrow[/math]zablokowanie syntezy kolagenu skutkuje wystąpieniem szkorbutu, czyli uszkodzeniu skóry, błon śluzowych i wypadaniu zębów). Łańcuchy kolagenu składają się z triad aminokwasów: Gly(glicyna)-X-Y (X, Y - inne aminokwasy, np. prolina i hydroksyprolina). Niewiele innych białek wykazuje taką regularność mającą tendencję do przyjmowania określonej konformacji (na skutek oddziaływań między sobą). Trzy cząsteczki kolagenu skręcają się spontanicznie w podjednostki zwane tropokolagenem (tropokolagen ma strukturę potrójnej, ściśle upakowanej helisy). Białka kolagenowe, oprócz charakterystycznych domen trihelikalnych, posiadają w swojej budowie fragmenty nie objęte strukturą potrójnej helisy (mogą one występować na końcach cząsteczki tropokolagenu, bądź też przedzielać strukturę trihelikalną. Jak już wspomniano wcześniej kolagen (bez względu na typ) wykazuje wysoką zawartość glicyny(33,5%), proliny (12%) i hydroksyproliny (10%) - co daje 55% aminokwasów tworzących kolagen. Ostatni z nich nie występuje w innych białkach organizmu, dlatego ilość jego w moczu jest miarą szybkości rozpadu kolagenu.
- <videoflash>YmuFI1jtc8M</videoflash>
Ze względu na wytwarzane struktury przestrzenne kolageny można podzielić na:
- tworzące włókna (I, II, III, V, XI)
- tworzące mikrowłókna (VI)
- występujące na obrzeżach włókien (IX)
- błonowe (IV, VIII)
- kotwiczące (VII)
Poniższa tabela przedstawia podział kolagenów na grupy.
Typ kolagenu Opis Rozmieszczenie I Grube prążkowane włókna kolagenowe (kolagen włóknisty); najbardziej powszechnie występujący rodzaj kolagenu w ludzkim organizmie, odporny na rozciąganie skóra właściwa, kość, więzadła, powięzie, chrząstka włóknista, rogówka, tkanka łączna włóknista II Cienkie prążkowane włókna kolagenowe; interakcja (słaba) z siarczanem dermatanu; W porównaniu z kolagenem typu I cechuje się większą zawartością hydroksylizyny i hydroksylizylopochodnych glikozydów, przy równocześnie mniejszej zawartości lizyny; Charakterystyczną cechą kolagenu typu II jest tworzenie włókien o małej średnicy, o dużej sprężystości i odporności na obciążenie. Chrząstka szklista, chrząstka sprężysta, krążki międzykręgowe, ciała szkliste III Cienkie prążkowane włókna kolagenowe, nazwane siateczkowymi wykazujące srebrochłonność; powszechny podobnie jak kolagen I, ale nieobecny w ścięgnach i kościach; występuje w tkance tworzącej się z fibroblastów, w trakcie zabliźniania ran, zanim zostanie wytworzony kolagen typu I; stosunek ilościowy kolagenu typu III do kolagenu typu I decyduje o średnicy włókien. Stwierdzono, że włókna o wysokiej zawartości kolagenu typu III cechują się małą średnicą. Pozwala to przypuszczać, że kolagen tego typu reguluje grubość włókien kolagenowych. Naczynia krwionośne, narządy miąższowe, szpik kostny, narządy limfatyczne mięśnie gładkie, nerw, płuca, skóra IV Cienkie warstwy; białko to jest prawie całkowicie nierozpuszczalne ze względu na liczne wiązania z innymi składnikami błon podstawnych. Błony podstawne (występuje w mikrowłóknach międzytkankowych, tworzących cienkie membrany między różnymi tkankami organizmu), blaszki zewnętrzne, torebka soczewki V Cienkie włókienka; występuje na granicy tkanki tworzącej blizny i tkanek na krawędzi blizn – występuje zawsze jako dopełnienie kolagenu typu I Błona podstawna w łożysku, mięsień gładki, mięsień szkieletowy VI Cienkie włókienka; odmiana typu V – spełniająca tę samą funkcję Wszechobecny VII Krótkie prążkowane włókienka; włókna kolagenu typu VII wnikają bezpośrednio do błon podstawnych, dlatego też zasadniczą rolą tego białka jest wiązanie błon podstawnych do otaczającego podścieliska. Włókienka kotwiczące w błonie podstawnej naskórka (m.in. w skórze i na powierzchni tętnic) i owodni VIII Morfologia niepewna Śródbłonek – tkanki tworzące błony śluzowe oraz wnętrze żył i tętnic IX Morfologia niepewna Chrząstka - razem z typem II X Morfologia niepewna; charakteryzują się licznymi fragmentami nie objętymi strukturą potrójnej helisy. Są obecnie przedmiotem intensywnych badań. Chrząstka wapniejąca XI Morfologia niepewna Chrząstka - razem z typem II Ze względu na to, że kolagen występuje szczególnie w dużych ilościach w kościach, chrząstkach, ścięgnach, więzadłach oraz w skórze, można stwierdzić że jest podstawą biernego narządu ruchu (kości i układu stawowo-więzadłowego). Podstawową funkcją kolagenu nie jest wypełnianie przestrzeni międzykomórkowej, tylko zapewnienie tkance wytrzymałości mechanicznej (twardości, sztywności oraz sprężystości).
Znaczenie roli kolagenu ilustrują najlepiej dwie choroby:
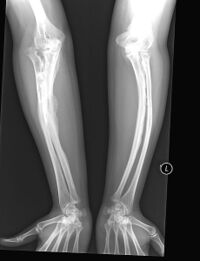
- osteogenesis imperfecta - wada genetyczna (najczęściej punktowe mutacje genów kodujących kolagen typu I) prowadząca do nieprawidłowego tworzenia kolagenu, który powoduje nadmierną łamliwość kości. Złamania występują często a zarazem bardzo szybko się zrastają. Występuje ogromna giętkość kości, przez co przybierają one kształty łuków
- zespół Ehlersa-Danlosa - nadmierna rozciągliwość skóry i tkanek otaczających stawy, co prowadzi do częstych zwichnięć
Kolagen uczestniczy zarówno w wielu procesach fizjologicznych jak i patologicznych (wiąże wodę w tkance, bierze udział w procesie krzepnięcia krwi, w procesach związanych z gojeniem się ran, tworzeniem blizny czy regeneracji kości po złamaniach).
- fibrylina — glikoproteina, główny składnik pozakomórkowych mikrofibryli wchodzących w skład włókien sprężystych (łącząc się z elastyną). Mikrofibrylee występują w płucach, skórze, ścianie naczyń krwionośnych, w substanicji pozakomórkowej kłębuszków naczyniowych ciałek nerkowych i we włóknach wieszadłowych soczewki. Mutacje genów kodujących fibrylinę-1 powodują wystapienie zespołu Marfana (gen, którego mutacje są odpowiedzialne za występowanie typowych dla tego zespołu objawów został zlokalizowany na chromosomie 15). Przyczyną zespołu Marfana jest uwarunkowane genetycznie uszkodzenie włókien sprężystych i zaburzenie w tworzeniu kolagenu oraz substancji podstawowej tkanki łącznej. Osobom z tym zespołem grozi miedzy innymi zwichnięcie soczewki oka (gdyż fibrylina występuje w włóknach więzadłowych) i pękniecie głównej tętnicy (niezdolność do odzyskania pierwotnej średnicy po rozciągnięciu powoduje jej osłabienie).
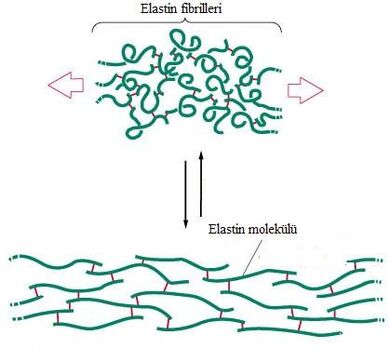
- elastyna — wytwarzane przez fibroblasty hydrofobowe (odpychające wodę) białko stanowiące główny składnik włókien sprężystych. Za pomocą wiązań poprzecznych organizuje się we włókna lub błony (pomiędzy cząsteczkami elastyny tworzą się kowalencyjne wiązania). Elastyna składa się z 750 reszt aminokwasowych, z których znaczną zawartość stanowią prolina (13%) oraz glicyna (34%), a nie ma w ogóle hydroksylizyny. Elastyna nadaje tkankom sprężystość i pozwala na odzyskanie pierwotnej postaci. W stanie rozluźnienia tworzy nieregularną spiralę, która jest podatna na rozciąganie.
- fibronektyna — wielofunkcyjna glikoproteina, która w macierzy pozakomórkowej może pełnić rolę nie tylko strukturalną, ale także regulującą oddziaływanie na osi komórka-macierz (interakcja z integrynami). Działając w parze z receptorem integrynowym (białkami błon komórkowych, biorącymi udział w procesach adhezji komórka-macierz lub komórka-komórka) doprowadza do przekazywania sygnałów ze środowiska zewnętrznego do wnętrza komórki, regulując tym samym organizację cytoszkieletu. Receptor integrynowy VLA-5 łączy ją z białkami cytoszkieletu taliną i winkuliną, które z kolei oddziałują z włóknami aktyny. Każdy z łańcuchów fibronektyny zbudowany jest z powtarzających się motywów aminokwasowych (typu I, II i III), które są rozmieszczone nieregularnie i tworzą strukturę mozaikową białka. Białko to potrafi zmienić swoją strukturę przestrzenną w zależności od warunków środowiska i potrzeb organizmu.
Fibronektyna występuje w 3 głównych formach:
- jako białko łączące się z powierzchnią komórek - co umożliwia adhezję komórek do substancji pozakomórkowej
- jako krążące białko osocza
- jako nierozpuszczalne włókienka wchodzące w skład substancji pozakomórkowej.
- białka niewłókniste — łączące się z receptorami na powierzchni komórek.
- laminina — usiarczanowana glikoproteina wytwarzana przez większość komórek nabłonka i śródbłonka; główna pozakomórkowa cząsteczka łącząca komórki i substancje pozakomórkową; jej cząsteczki mają kształt krzyży.
- entaktyna (nidogen) — usiarczanowana glikoproteina, składnik wszystkich błon podstawnych; fizjologicznie jest łącznikiem pomiędzy integrynami błony komórkowej i kolagenem typu IV (który stanowi blaszkę gęstą błony podstawnej) oraz lamininą.
- tenascyna — pozakomórkowa glikoproteina biorąca udział w adhezji komórek.
BŁONA PODSTAWNA I ADHEZJA KOMÓREK DO SUBSTANCJI POZAKOMÓRKOWEJ
Budowa
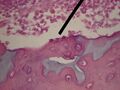
Błona podstawna jest powierzchnią specjalną macierzy zewnątrzkomórkowej. Jest to cienka warstewka (grubość około 0,05 mikrometra) substancji międzykomórkowej oddzielająca nabłonki od położonych głębiej tkanek. Błona podstawowa nie zawiera komórek i ma postać cienkich blaszek podstawnych lub błon podstawnych, na których spoczywają warstwy komórek nabłonkowych, ale otacza także komórki mięśniowe, tłuszczowe i nerwy obwodowe. Zbudowana jest z kilku warstw:
- blaszka jasna/rzadka (lamina lucida) - 60 nm, jest zbudowana z lamininy (proteoglikanu) i kolagenu (typu IV)
- blaszka gęsta (lamina densa) - 30-100 nm, składa się z kolagenu typu VII
- blaszka siateczkowata (lamina reticularia) - zmienna grubość; zakotwicza błonę podstawną w macierzy pozakomórkowej na 3 sposoby:
- kolagen typu III łączy się z wypustką blaszki gęstej, która wnika do blaszki siateczkowatej
- włókna kotwiczące (kolagen typu VII) łączą błonę podstawną z macierzą pozakomórkową
- włókna sprężyste w macierzy pozakomórkowej łączą się z błona podstawną i mikrofilamentami fibrylinowymi
Funkcje
- tworzenie powierzchni styku pomiędzy --> możliwość adhezji (zakotwiczania się w błonie podstawnej, która jest ściśle związana z substancją pozakomórkową)
- tworzenie bariery przepuszczalności --> nie wszystkie substancje mogą przedostać się przez błonę podstawną, ponieważ jej struktura czyni ją selektywnym filtrem (tak zwanym filtrem dyfuzyjnym). Przykłady:
- w naczyniach krwionośnych stopuje przenikanie do tkanek białek, które mają dużą masę cząsteczkową
- w płucach umożliwia wymianę gazów
- w nerkach zapobiega utracie białek z filtrowanej krwi
- kontrola organizacji i różnicowania komórek (dzieje się to poprzez oddziaływanie receptorów, które znajdują się na jej powierzchni oraz cząstek w macierzy pozakomórkowej)
Główne składniki
- kolagen typu IV
- laminina
- siarczan heparanu
- entaktyna
- fibronektyna
- inne: małe ilości słabo scharakteryzowanych białek i GAG-ów
Połączenia pomiędzy komórkami i macierzą pozakomórkową
- płytki przylegania - w tych miejscach fibronektyna łączy wewnątrzkomórkową sieć aktynową z substancją pozakomórkową
- receptory lamininy - tam gdzie laminina stanowi główny składnik błony podstawej
- półdesmosomy (hemidesmosomy) - filamenty cytokeratynowe zakotwiczają się w błonie podstawnej (patrz. Rys. 5 - poprzedni rozdział)
- nieintegrynowe glikoproteiny, które wystepują na powierzchni komórek wiążą się między innymi z kolagenem macierzy pozakomórkowej
Pytania do wykładu
- Jaką funkcję pełni macierz pozakomórkowa?
- Dlaczego jakość życia komórki jest silnie uzależniona od czystości macierzy?
- Jakie są główne składniki macierzy pozakomórkowej?
- Na czym polegają choroba osteogenesis imperfecta oraz zespół Ehlersa-Danlosa?
- Przez jakie komórki wytwarzana jest macierz pozakomórkowa?
- Jakie występują rodzaje połączeń pomiędzy komórkami i macierzą pozakomórkową?
- Jak jest zbudowana i jakie funkcje pełni błona podstawna?