
Metody Biofizyki Molekularnej/Metody relaksacyjne
Spis treści
Podział reakcji chemicznych ze względu na szybkości przebiegu
| Ultra-szybkie | → | piko- nano- ,mikrosekundy |
| Szybkie | → | sekundy |
| Średnio-szybkie | → | minuty – godziny |
| Wolne | → | tygodnie |
| Bardzo wolne | → | tygodnie – lata |
Szybkość zależy od:
- stężenia reaktantów, katalizatorów i inhibitorów,
- temperatury,
- ciśnienia,
- przenikalności dielektrycznej.
Historia
- W 1850 roku L. Wilhelmy, wykonał hydrolizę sacharozy do glukozy i fruktozy, inicjowaną dodaniem kwasu. Reakcję monitorował mierząc skręcalność optyczną roztworu.
- W 1901 roku doktorant Waltera Nernsta zmierzył prędkość dźwięku m.in. w NO2 i zaobserwował zmiany koloru z brązowego (monomer) na bezbarwny (dimer) spowodowane zmianami ciśnienia w polu fali akustycznej.
- W 1920 roku A. Einstein zasugerował, że szybkość reakcji N2O4↔2NO2 można określić poprzez pomiar dyspersji dźwięku.
- W 1923 roku H. Hartridge i F.J.W. Roughton skonstruowali urządzenie przepływowe do mieszania dwóch roztworów, mieszanina przepływa przez długą rurę obserwacyjną, wzdłuż której umieszczone są detektory mierzące postęp reakcji.
- W 1940 roku B. Chance zbudował podobny przyrząd z zatrzymaniem przepływu i jednym detektorem.
- W 1947 roku R.G.W. Norrish i G. Porter skonstruowali spektrometr fotolizy błyskowej, w którym poprzez krótki i silny impuls światła inicjowane są reakcje chemiczne.
- W 1953 roku M. Eigen opisał zastosowanie metod absorbcji ultradźwięków, skoku pola elektrycznego i skoku temperatury do badania reakcji jonowych w roztworach wodnych, o czasach połówkowych aż do 1 ns; za co w 1967 roku otrzymał wraz R.G.W. Norrishem i G. Porterem Nagrodę Nobla.
Co możemy mierzyć ultra-szybkimi metodami ?
Przemiany jednocząsteczkowe
- [math]A\underset{k_{-1}}\overset{k_{+1}}\Longleftrightarrow B\;[/math]
Procesy asocjacji jedno- i wieloetapowe
- [math]B+L\underset{k_{-1}}\overset{k_{+1}}\Longleftrightarrow K\;[/math]
- [math]B+L\underset{k_{-1}}\overset{k_{+1}}\Longleftrightarrow B^* +L\underset{k_{-2}}\overset{k_{+2}}\Longleftrightarrow K\;[/math]
- [math]B+L\underset{k_{-1}}\overset{k_{+1}}\Longleftrightarrow K_1\underset{k_{-2}}\overset{k_{+2}}\Longleftrightarrow K_2\;[/math]
Skomplikowane przemiany kinetyczne, np. dla białek oligomerycznych
Celem badań jest powiązanie obserwowanego sygnału z odpowiednim mechanizmem asocjacji, wykazanie że wybrany mechanizm w pełni tłumaczy obserwacje doświadczalne i wyznaczeniu parametrów kinetycznych.
Jednoetapowe procesy asocjacji
- [math]B+L\underset{k_{-1}}\overset{k_{+1}}\Longleftrightarrow K\;[/math]
Gdy stężenie ligandu jest znacznie większe od stężenia białka, mamy do czynienia z reakcją pseudopierwszego rzędu, mierzony sygnał można przedstawić w postaci zależności monoeksponencjalnej
- [math]I(t) = A_1e^{-k_\mathrm{obs}t}+A_0\;[/math]
a obserwowana stała szybkości wiąże się ze stałymi szybkości reakcji elementarnych wzorem:
- [math]k_\mathrm{obs} = k_{+1}[L]_0 +k_{-1}\;[/math].
Dwuetapowe procesy asocjacji — wiązanie i izomeryzacja
Gdy [math][L]_0 \gg [B]_0\;[/math] obserwowany sygnał jest dwueksponencjalną funkcją czasu:
- [math]B+L\underset{k_{-1}}\overset{k_{+1}}\Longleftrightarrow K_1\underset{k_{-2}}\overset{k_{+2}}\Longleftrightarrow K_2\;[/math]
- [math]I(t) = A_0+A_1e^{-k_{\mathrm{obs},1}t}+A_2e^{-k_{\mathrm{obs},2}t}\;[/math]
- [math]k_{\mathrm{obs},1} = k_{+1}[L]_0 +k_{-1}\;[/math]
- [math]k_{\mathrm{obs},2} = k_{-2}+\frac{k_{+2}}{1+\frac{K_1}L}\;[/math]
- [math]K_1 = \frac{k_{-1}}{k_{+1}}\;[/math]
W warunkach równowagowych dla [math][K]_1\ \text{i}\ [K]_2=0\ \text{dla}\ t=0[/math], obserwowany sygnał jest monoeksponencjalny, z
- [math]k_\mathrm{obs} = \frac{k_{+1}[L]_0(k_{+2}+k_{-2})+k_{-1}k_{-2}}{k_{1}[L]_0+k_{-1}k_{+2}}\;[/math]
Gdy [math]k_{-1}\gg k_{+2}\;[/math].
- [math]k_\mathrm{obs} =k_{+2}+\frac{k_{-2}}{1+\frac{K_1}{[L]}}\;[/math]
Przepływowe metody relaksacyjne
Metody przepływowe (……..-flow)
Ważne!
- Kontrola temperatury.
- Czas mieszania reagentów (1-5 ms) musi być zaniedbywalny w porównaniu z czasem reakcji.
- Analiza danych musi być możliwa do wykonania dla skal czasowych odpowiadających przebiegowi reakcji (odpowiedni zestaw danych).
Pomiary relaksacyjne — etapy:
- Wybór techniki pomiaru.
- Urzygotowanie próbki.
- Odgazowanie,
- Wybór metody śledzenia reakcji,
- Ew. wybór fali wzbudzenia.
- Wybór sposobu obserwacji:
- Wybrana długość fali.
- Filtry interferencyjne.
- Filtry cut-off.
- Pomiary wstępne.
- Ustalenie wartości czasu martwego.
- Ślepe próby.
- Dobór czasu obserwacji.
- Dobór ilości strzałów potrzebnych do zastąpienia roztworów.
- Dobór uśrednianej liczby prób.
- Uważne monitorowanie reakcji (odrzucenie artefaktów).
- Analiza danych.
- Wnioski.
Techniki eksperymentów
- Zatrzymany przepływ
Dwa roztwory są wstrzykiwane do komory mieszania, a następnie przepływają przez kuwetę. Za kuwetą znajduje się strzykawka stopująca przepływ w określonym czasie. Obserwuje się zmiany stężeń reagentów w funkcji czasu, w określonej pozycji. Potrzebne są szybkie metody detekcji (zazwyczaj spektrofotometryczne).
Zaleta: małe zużycie reagentów. - Ciągły przepływ
Po wstrzyknięciu do komory mieszania i wymieszaniu reagenty przepływają w sposób ciągły ze stałą prędkością v, a stężenie produktów zwiększa się wraz z odległością od komory mieszania (stężenie i odległość zwiększa się z czasem).
Wada: zużycie dużych ilości reagentów. - Przyspieszony przepływ
Odmiana techniki ciągłego przepływu. Tłoki strzykawek poruszają się z przyspieszeniem, powodując zwiększenie szybkości przepływu reagentów w kuwecie pomiarowej. Stężenie produktów w określonym punkcie odpowiada coraz krótszemu czasowi, jaki upłynął od czasu rozpoczęcia reakcji.
Wada: potrzebna bardzo szybka metoda detekcji - Wygaszony przepływ
Możliwość izolacji intermediatów i produktów reakcji na pewnym jej etapie i identyfikacji odpowiednią metodą analityczną. Technika komplementarna do zatrzymanego przepływu, gdy w trakcie reakcji nie zachodzą zmiany spektralne. Po wymieszaniu reagentów przepływają one przez odpowiednio dobraną pętlę opóźnienia, a następnie są mieszane z odczynnikiem blokującym reakcje. Zbierane próbki są przekazywane do analizy. Czas zatrzymania reakcji zależy od prędkości przepływu reagentów i długości pętli opóźniającej.
Zaleta: małe zużycie reagentów, możliwość zastosowania do substancji nieczynnych optycznie.
Najczęściej spotykane spektroskopowe metody monitorowania reakcji biochemicznych w poznanych technikach
- Zmiany absorpcji, np. w trakcie tworzenia się absorbujących układów.
- Zmiany fluorescencji — związane ze zmianą środowiska tryptofanu.
- Dichroizm kołowy— zmiana struktury układu.
Przykład (Biophys Chem. 2007, 125:260-8)
Opis procesu wiązania analogu obydwu substratów — inhibitora PME-6-thio-gua przez enzym PNP.
Wyjściowo — PNP składa się z identycznych podjednostek.
Rozpatrywane mechanizmy:
- Ligand jest wiązany przez każde z aktywnych miejsc w procesie jednoetapowym. [math]C_I\;[/math] — kompleks białko — [math]I\;[/math] cząsteczek liganda, po związaniu miejsca aktywne nie ulegają reorganizacji konformacyjnej.
- [math]P+L\underset{k_{-1}}\overset{k_{+1}}\Longleftrightarrow C_1 \;[/math]
- [math]C_1+L\underset{k_{-2}}\overset{k_{+2}}\Longleftrightarrow C_2 \;[/math]
- [math]C_2+L\underset{k_{-3}}\overset{k_{+3}}\Longleftrightarrow C_2 \;[/math]
- Ligand jest wiązany przez każde z aktywnych miejsc w procesie dwuetapowym (Schemat Figure 1).
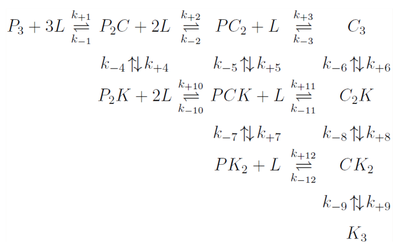
Najpierw wykonano pomiary stacjonarne na podstawie których wybrano odpowiednie fale dla wzbudzenia i obserwacji emisji.
Wykonano pomiary kontrolne (bufor-bufor, ligand-bufor, białko-bufor; ostatni w celu ustalenia początkowego poziomu fluorescencji i oszacowania czasu martwego). Następnie wykonano pomiary stopped-flow przy mieszaniu ligandu z buforem. Badano przebieg reakcji w różnym pH 6.5-8.2, przy różnym stężeniu białka i i inhibitora. Mierzonym sygnałem była fluorescencja. Zakładaliśmy, że do całkowita fluorescencja jest sumą wkładów od wolnego ligandu, białka i wszystkich możliwych kompleksów ligand-białko.
- [math]F(t) =\sum_{x} F_x\cdot c_x(t)\;[/math].
Otrzymane przebiegi były jednocześnie analizowane numerycznie przy założeniu różnych modeli reakcji.
Wniosek: obserwowany proces jest dobrze opisany modelem jednoetapowym. Stałe asocjacji malały wraz ze wzrostem pH (enzym „nie lubi” formy anionowej inhibitora), stałe dysocjacji były niezależne od pH.
Metody perturbacyjne
Ominięcie problemu związanego z maksymalnie szybkim mieszaniem reagentów dla ultraszybkich reakcji.
W czasie [math]t=0\;[/math] mieszanina reakcyjna jest w równowadze chemicznej. Następnie gwałtownie zaburza się warunki stacjonarne i obserwuje sposób dochodzenia mieszaniny do nowej równowagi w zmienionych warunkach.
- Błyskowa fotoliza laserowa (laser flash photolysis).
- Skok temperatury (T-jump): wymagana zmiana [math]\Delta H\;[/math].
- Skok ciśnienia (pressure jump): wymagana zmiana [math]\Delta V\;[/math].
- Impuls pola elektrycznego (electric field impulse): w reakcji musi wystąpić jonizacja.
- Skok pH (pH-jump): stan molekuły musi się zmieniać w niewielkim zakresie pH.
Błyskowa fotoliza laserowa
Kondensator jest rozładowany przez lampę błyskową wypełniona kryptonem, argonem lub ksenonem, co powoduje intensywny błysk światła. Ogniskowanie na próbce powoduje lokalne niestabilne wzbudzenie molekuł. Molekuły mogą się rozpaść i reagować dalej, mogą uwolnić zaabsorbowaną energię różnymi drogami i wrócić do stanu podstawowego.
Skok temperaturowy
Jest osiągany poprzez :
- rozładowanie kondensatora poprzez roztwór w kuwecie,
- intensywny impuls laserowy,
- zmiany temperatury są rzędu 5 — 10°C.
Skok pH
Wykorzystuje się związki, które pod wpływem intensywnego impulsu laserowego uwalniają protony, np. 2-NBA (2-Nitrobenzaldehyde). Mieszaninę próbka — NBA umieszcza się w kuwecie i oświetla błyskiem światła. Możliwe zmiany pH są rzędu 2.
Zwykle relaksacyjne powroty do równowagi można opisać równaniem eksponencjalnym.
- [math]\Delta A(t) = \Delta A(0) e^{-\frac t\tau}\;\;[/math],
τ — czas relaksacji.
Przykładowo dla reakcji:
- [math]A+B\overset{k_1}\underset{k_{-1}}\Longleftrightarrow P\;[/math].
Mamy [math]\frac{\mathrm d[P]}{\mathrm dt} = k_1 [A][B]-k_{-1}[P]\;[/math] i [math]\frac{k_1}{k_{-1}} = \frac{[P]_\mathrm{eq}}{[A]_\mathrm{eq}[B]_\mathrm{eq}}\;[/math]. W równowadze:
- [math][P] = [P]_\mathrm{eq} +\Delta [P]\;[/math],
- [math][A] = [A]_\mathrm{eq}+\Delta [A] = [A]_\mathrm{eq}-\Delta [P]\;[/math],
- [math][B] = [B]_\mathrm{eq}+\Delta [V] = [B]_\mathrm{eq}-\Delta [P]\;[/math],
- [math]\Delta [P] = -\Delta [A]_\mathrm{eq} = \Delta [B]_\mathrm{eq}\;[/math].
Warunki graniczne:
- [math]\Delta [P]_{(t=0)} = \Delta [P]_0\;[/math],
- [math]\Delta [P]_{(t=\infty)} = 0\;[/math].
Podstawiając:
- [math]\frac{\mathrm d[P]}{\mathrm dt} = \frac{\mathrm d([P]_\mathrm{eq}+\Delta ]P])}{\mathrm dt}=\frac{\mathrm d(\Delta [P])}{\mathrm dt} = k_1[A][B]-k_{-1}[P]\;[/math],
- [math]\frac{\mathrm d[P]}{\mathrm dt}=k_1([A]_\mathrm{eq}-\Delta [P])([B]_\mathrm{eq}-\Delta [P]) -k_{-1}([P]_\mathrm{eq}+\Delta[P])\;[/math],
- [math]\frac{\mathrm d[P]}{\mathrm dt}=k_1[A]_\mathrm{eq}[B]_\mathrm{eq}-k_{-1}[P]_\mathrm{eq}-k_1(([A]_\mathrm{eq}\Delta[P]+[B]_\mathrm{eq}\Delta[P])-(\Delta [P])^2) - k_{-1}\Delta [P] = -(k_1([A]_\mathrm{eq}+[B]_\mathrm{eq})+k_{-1})\Delta [P]\;[/math],
dla małych odchyleń od równowagi
- [math]-\frac{\mathrm [P]}{\mathrm dt} = \frac{\Delta [P]}\tau\;[/math].
Otrzymujemy:
- [math]\tau = \frac 1{k_{-1}+k_1([A]_\mathrm{eq}+[B]_\mathrm{eq})}\;[/math].