Pracownia Podstaw Biofizyki/PPB4d
Denaturacja albuminy z krwi wołu pod wpływem chlorowodorku guanidyny — pomiary fluorescencyjne (dr Anna Modrak-Wójcik)
Spis treści
Wstęp
Badania procesów zwijania i rozwijania białek stanowią ważną grupę zagadnień biofizyki molekularnej. W przypadku większości białek, przyjęcie prawidłowej (natywnej) struktury przestrzennej jest konieczne dla pełnienia specyficznej funkcji biologicznej. Alternatywna konformacja zwykle prowadzi do powstania cząsteczki o odmiennych właściwościach, która może być toksyczna dla organizmu. U podłoża wielu chorób (np. mukowiscydozy czy chorób neurodegeneracyjnych) leży zaburzenie procesu zwijania się białek, często prowadzące do powstawania agregatów (włókna amyloidowe).
Denaturacja to proces prowadzący do zniszczenia struktury II, III- i IV-rzędowej białka natywnego i utraty aktywności biologicznej makrocząsteczki. Sekwencja aminokwasowa jest zachowana, gdyż czynniki denaturujące zaburzają oddziaływania stabilizujące strukturę przestrzenną białka – wiązania wodorowe, mostki solne, oddziaływania hydrofobowe, wiązania disiarczkowe. Denaturację mogą wywołać zarówno czynniki fizyczne (ogrzewanie, wytrząsanie, naświetlanie promieniowaniem UV, jonizującym, rentgenowskim), jak i chemiczne (kwasy, zasady, jony metali ciężkich, mocznik, chlorowodorek guanidyny). Mocznik oraz chlorowodorek guanidyny (Rys. Figure 1) należą do grupy związków chaotropowych (ang. chaotrope — czyniący chaos). Powodują silne zaburzenie sieci wiązań wodorowych, co skutkuje destabilizacją struktury białka i jego denaturacją. Obecność chlorowodorku guanidyny o stężeniu 6 M niszczy trzeciorzędową i drugorzędową strukturę białek, a większość z nich przybiera w tych warunkach formę kłębka statystycznego (random coil). Chlorowodorek guanidyny jest najczęściej wykorzystywanym czynnikiem denaturującym w badaniach mechanizmu zwijania się białek.
Proces denaturacji białek może być obserwowany przy użyciu różnych technik eksperymentalnych, takich jak spektroskopia absorpcyjna i emisyjna w zakresie UV/Vis, dichroizm kołowy czy NMR. Pomiary fluorescencyjne wyróżniają się wysoką czułością i specyficznością.
Właściwości fluorescencyjne białek
Za absorpcję i fluorescencję białek w zakresie UV odpowiedzialne są aminokwasy aromatyczne: tryptofan (Trp), tyrozyna (Tyr) i fenyloalanina (Phe). Związki te posiadają pierścienie ze sprzężonym układem węglowych wiązań podwójnych typu π (Rys. Figure 2), co powoduje zmniejszenie różnicy energetycznej między poziomami π i π* i wzrost prawdopodobieństwa przejść π→ π* i π*→ π.
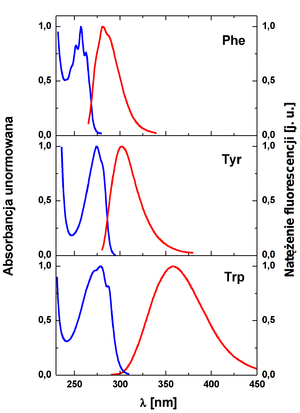
Maksimum absorpcji tryptofanu przypada w 278 nm (Rys. Figure 3, Rys. Figure 4). Położenie maksimum emisji silnie zależy od polarności rozpuszczalnika, w roztworach wodnych wynosi ok. 355 nm, w solwentach niepolarnych przesuwa się w stronę krótszych fal. Tyrozyna posiada maksimum absorpcyjne w 274 nm, a położenie pasma emisji (maksimum w 303 nm) nie zależy od polarności otoczenia. Fenyloalanina charakteryzuje się najbardziej krótkofalowym widmem absorbcji i emisji, z maksimum odpowiednio w 260 i 280 nm i najniższą wydajnością kwantową (Rys. Figure 3, Rys. Figure 4). Spośród widm absorbcji aminokwasów aromatycznych, widmo absorpcji tryptofanu sięga najdłuższych fal. Umożliwia to selektywne wzbudzanie fluorescencji reszt tryptofanowych w białkach (dla wzbudzeń powyżej 295 nm).
| aminokwas | absorpcja [math]\lambda_{\mathrm{max}}[/math] [nm] | [math]\varepsilon(\lambda_{\mathrm{max}})[/math] [M-1cm-1] | emisja [math]\lambda_{\mathrm{max}}[/math] [nm] | wydajność kwantowa |
|---|---|---|---|---|
| Phe | 258 | 200 | 282 | 0,02 |
| Tyr | 274 | 1400 | 303 | 0,14 |
| Trp | 278 | 5600 | 355 | 0,13 |
Absorpcja i fluorescencja białek jest zdominowana przez tryptofan. Po pierwsze, tryptofan posiada najwyższy współczynnik ekstynkcji spośród trzech aminokwasów aromatycznych (Rys. Figure 3). Po drugie, pomimo że wydajności kwantowe tyrozyny i tryptofanu w roztworze są podobne, w białkach natywnych emisja pochodząca od tyrozyny jest często wygaszana, przede wszystkim w wyniku bezpromienistego rezonansowego przeniesienia energii (FRET, ang. Förster resonance energy transfer) między tyrozyną a tryptofanem.
Ze względu na mały współczynnik ekstynkcji i niską wydajność kwantową fenyloalaniny (w białku dodatkowo obniżoną przez FRET między Phe i Tyr lub Trp), fluorescencja Phe jest obserwowana praktycznie tylko w przypadku braku w sekwencji aminokwasowej białka pozostałych dwóch aminokwasów aromatycznych.
FRET jest zjawiskiem przekazania energii między pierwotnie wzbudzonym donorem a niewzbudzonym akceptorem. Przekazanie energii zachodzi bez emisji fotonu, na skutek długozasięgowego oddziaływania dipol-dipol z udziałem donora i akceptora. Wydajność tego procesu zależy między innymi od stopnia nakładania się widma emisji donora i absorpcji akceptora oraz od odległości donor-akceptor. Odległości, które pozwalają na zajście FRET są porównywalne z rozmiarami makrocząsteczek biologicznych (20-60 Å). Ze względu na częściowe przekrywanie się widma fluorescencji fenyloalaniny z widmem absorpcji tyrozyny i tryptofanu oraz widma fluorescencji tyrozyny z widmem absorpcji tryptofanu (Rys. Figure 4) w białkach często mamy do czynienia z bezpromienistym przeniesieniem energii pomiędzy fenyloalanią a tyrozyną lub tryptofanem oraz pomiędzy tyrozyną i tryptofanem.
Spektroskopia emisyjna jest doskonałym narzędziem do badania procesu denaturacji białek. Emisyjne właściwości reszt tryptofanowych w białkach natywnych (położenie maksimum widma emisji, wydajność kwantowa) silnie zależą od ich od lokalnego otoczenia. Białka posiadające reszty tryptofanowe w otoczeniu hydrofilowym mają maksimum emisji zbliżone do maksimum emisji tryptofanu w roztworze wodnym. Maksimum przesuwa się w kierunku fal krótszych wraz odizolowaniem reszt od środowiska wodnego (do 330-340 nm). Różnorodność tę znosi denaturacja, w wyniku której wszystkie reszty aminokwasowe mają kontakt z rozpuszczalnikiem (random coil). Rozwinięcie białka prowadzi także do wzrostu odległości między resztami aminokwasowymi, między którymi zachodziło bezpromieniste przeniesienie energii (FRET). W związku z tym, jeśli w sekwencji aminokwasowej obecne są tyrozyny, w widmie emisji białek zdenaturowanych, oprócz piku tryptofanowego, często pojawia się pasmo pochodzące od tyrozyn.
Podczas ćwiczenia zbadasz proces rozwijania albuminy z krwi wołu (BSA) pod wpływem chlorowodorku guanidyny. Albumina jest głównym białkiem występujący w osoczu krwi. Zawiera 583 aminokwasy, w tym 2 tryptofany i 20 tyrozyn. Jeden z tryptofanów znajduje się w otoczeniu silnie hydrofobowym, drugi jest wyeksponowany do roztworu. Ponad 67% struktury drugorzędowej BSA to α-helisy. Główną jej funkcją jest transport kwasów tłuszczowych i metabolitów. Rysunek Figure 5 przedstawia strukturę krystalograficzną ludzkiej albuminy, która przejawia 76% homologii z BSA.
Wymagania do kolokwium wstępnego
- Zjawisko absorpcji i emisji promieniowania elektromagnetycznego.
- Zasada pomiaru absorpcji i fluorescencji, widmo absorbcji, widma emisji i wzbudzenia fluorescencji.
- Budowa białek.
- Oddziaływania stabilizujące strukturę przestrzenną białek.
- Denaturacja białek.
- Właściwości absorpcyjne i emisyjne aminokwasów (wolnych i w białkach), wpływ środowiska.
- Försterowskie rezonansowe przeniesienie energii (FRET).
Przebieg ćwiczenia
Podczas ćwiczenia prześledzisz proces denaturacji albuminy z krwi wołu (BSA) pod wpływem chlorowodorku guanidyny (GdnHCl). Wykonasz pomiary widm emisji fluorescencji BSA w funkcji stężenia denaturanta dla dwóch różnych wartości fali wzbudzenia (280 i 295 nm) za pomocą spektrofluorymetru Tau-3 (Horiba Jobin Yvon).
Masz do dyspozycji:
- 50 mM bufor Tris-HCl pH 7,2,
- 35 μM roztwór BSA w 50 mM buforze Tris-HCl pH 7,2,
- 6 M roztwór GdnHCl w 50 mM buforze Tris-HCl pH 7,2,
- kwarcową kuwetę fluorescencyjną 0,4 x 1 cm.
- Przygotuj roztwory GdnHCl w 50 mM buforze Tris-HCl pH 7,2 poprzez rozcieńczanie stężonego roztworu chlorowodorku guanidyny (6 M) wg poniższego schematu:
- M GdnHCl => 0,75 ml 6 M GdnHCl + 3,75 ml buforu
- M GdnHCl => 1,5 ml 6 M GdnHCl + 3,0 ml buforu
- M GdnHCl => 2,25 ml 6 M GdnHCl + 2,25 ml buforu
- M GdnHCl => 3,0 ml 6 M GdnHCl + 1,5 ml buforu
- M GdnHCl => 3,75 ml 6 M GdnHCl + 0,75 ml buforu
- Przygotuj roztwory BSA w 50 mM buforze Tris-HCl pH 7,2 oraz w 50 mM buforze Tris-HCl pH 7,2 zawierającym różne stężenia GdnHCl (1, 2, 3 ,4, 5 i 6 M). Do 1,85 ml odpowiedniego buforu dodaj po 150 μl stężonego BSA (35 μM) i wymieszaj. Pozostaw roztwory w temperaturze pokojowej na około dwie godziny. Ile wynosi stężenie BSA po rozcieńczeniu?
- Kuwetę fluorescencyjną napełnij 1,4 ml 50 mM buforu Tris-HCl pH 7,2. Zarejestruj widma emisji fluorescencji dla wzbudzenia 280 i 295 nm w zakresie odpowiednio 285-500 i 300-500 nm. Szerokości spektralne szczeliny wzbudzającej i emisyjnej ustaw równe 4 nm, a czas integracji 0,5 s/nm. Widma zarejestruj w modzie s/r (w ten sposób niwelujesz fluktuacje natężenia lampy w czasie oraz różnice w intensywności świecenia lampy w różnych długościach fali). W analogiczny sposób przeprowadź pomiary dla roztworów GdnHCl. W ten sposób uzyskasz widma emisyjne tła.
- Przeprowadź analogiczne pomiary dla roztworów BSA.
Opis końcowy
Opis końcowy powinien zawierać poszczególne elementy charakterystyczne dla raportu z przebiegu eksperymentu (streszczenie, wstęp teoretyczny, opis układu doświadczalnego oraz wyniki i ich dyskusję).
Wyniki należy opracować korzystając z programu ORIGIN lub PRISM (dostępne na komputerach w Pracowniach Komputerowych w Zakładzie Biofizyki i w sali 112 w budynku dydaktycznym przy ul. Pasteura 7) i udokumentować za pomocą czytelnych tabel i wykresów.
Opracowanie wyników powinno uwzględniać następujące zagadnienia:
- Analizę i interpretację zależności widm emisji fluorescencji albuminy od stężenia chlorowodorku guanidyny.
- Wyznaczenie zależności położenia maksimum widma emisji BSA od stężenia GdnHCl.
- Wyznaczenie zależności natężenia fluorescencji BSA w 300 i 350 nm (dla wzbudzenia w 280 nm) oraz w 305 i 350 nm (dla wzbudzenia w 295 nm) od stężenia GdnHCl.
Przy opracowywaniu danych pamiętaj o odjęciu tła pochodzącego od rozpuszczalnika.
Literatura
- „Biofizyka. Wybrane zagadnienia wraz z ćwiczeniami”, red. Z. Jóźwiak i G. Bartosz, PWN 2007
- „Biochemia”, J. M. Berg, J. L. Tymoczko, L. Stryer, PWN 2009
- „Podstawy spektroskopii molekularnej”, Z. Kęcki, PWN 1998
- „Principles of fluorescence spectroscopy” J.R. Lakowicz