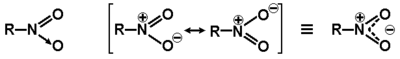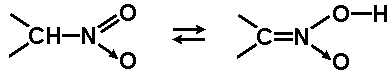CHEM:Chemia organiczna/Pochodne nitrowe węglowodorów
Spis treści
W porównaniu z dotychczas poznanymi grupami funkcyjnymi grupa nitrowa charakteryzuje się złożoną budową. W pochodnych nitrowych atom węgla tworzy wiązanie z atomem azotu, a ten z kolei związany jest z dwoma atomami tlenu. Formalnie wzór strukturalny pochodnych nitrowych można rozpisać tak, jak pokazano poniżej na Rys. Figure 1. (wzór po lewej stronie). Należy jednak pamiętać, że w obrębie grupy nitrowej występuje wiązanie zdelokalizowane (zjawisko mezomerii) i oba atomy tlenu są równocenne pod względem fizykochemicznym (wzór po prawej stronie rysunku).
Obecność grupy nitrowej w nazewnictwie związków organicznych zaznacza się przedrostkiem "nitro", poprzedzonym odpowiednim lokantem wskazującym numer atomu węgla, przy którym znajduje się ten podstawnik, a rdzeń nazwy wywodzi się od węglowodoru macierzystego.
Związki nitrowe charakteryzują się dużym momentem dipolowym, jednak nie rozpuszczają się w wodzie. Pochodne nitrowe niższych węglowodorów łańcuchowych i nitrobenzen są cieczami, a pochodne wielonitrowe są na ogół ciałami stałymi.
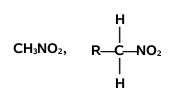
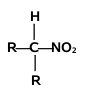
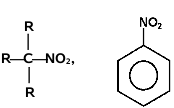
Podobnie jak w przypadku poznanych dotąd związków rozróżniamy pochodne nitrowe o różnej rzędowości:
|
|
|
| związki nitrowe pierwszorzędowe | związek nitrowy drugorzędowy | związki nitrowe trzeciorzędowe |
Związki nitrowe niezwykle rzadko występują w przyrodzie. Ich znaczenie wiąże się z właściwościami wybuchowymi niektórych pochodnych np. trotyl to 2,4,6-trinitrotoluen, oraz z zastosowaniem do syntezy innych organicznych związków zawierających azot. Wybrane pochodne nitrowe stosowane są też jako leki antyseptyczne (przeciwbakteryjne).
Kwasowe właściwości nitrowych pochodnych alkanów.
Pierwszo- i drugorzędowe pochodne nitrowe alkanów, czyli takie które zawierają przynajmniej jeden atom wodoru przy węglu związanym z grupa nitrową wykazują zdolność oddysocjowania protonu. I tak, związki te (jak było powiedziane wyżej — nierozpuszczalne w wodzie) rozpuszczają się w zasadowych roztworach wodnych dzięki tworzeniu rozpuszczalnych w wodzie soli:
- RCH2NO2 + NaOH —→ RCH=NO2-Na+ + H2O
W bezwzględnej skali kwasowości związki nitrowe są słabymi kwasami, zbliżonymi pod względem właściwości kwasowych do fenoli. Dysocjacji ulegają formy tautomeryczne związków nitrowych zwane odmianami aci:
Skłonność do oddysocjowania protonu od formy aci tłumaczy się stabilizacją mezomeryczną anionu po oderwaniu protonu. W anionie takim tworzy się wiązanie zdelokalizowane obejmujące swoim zasięgiem cztery atomy: azot, dwa atomy tlenu i atom węgla. Obrazowo opisując to zjawisko można powiedzieć, że układ dążąc do rozszerzenia efektu mezomerycznego na większą liczbę atomów pozbywa się protonu, przez co uzyskuje niższą energię wewnętrzną. Struktury graniczne anionu formy aci są podane na Rys. Figure 3.:
Aniony związków nitrowych w określonych warunkach stanowią odczynniki nukleofilowe i mogą ulegać reakcji typu kondensacji aldolowej.
Otrzymywanie i reakcje związków nitrowych.
Ogólną metodą otrzymywania związków nitrowych jest reakcja nitrowania węglowodorów za pomocą kwasu azotowego(V). W przypadku układów alifatycznych reakcja nitrowania wymaga wysokiej temperatury (ok. 400°C) z uwagi na dużą energię aktywacji rozerwania alifatycznych wiązań C—H. W tych ostrych warunkach przeważają reakcje wolnorodnikowe, prowadzące do tworzenia się różnych produktów, ponieważ rozerwaniu mogą ulegać również wiązania C—C. Odpowiedni przykład wielokierunkowości tej reakcji podany jest na Rys. Figure 4.:
Główne produkty nitrowania propanu.
| HNO3 | |||
| CH3CH2CH3 | ———→ | CH3NO2 | nitrometan |
| CH3CH2NO2 | nitroetan | ||
| CH3CH2CH2NO2 | 1-nitropropan | ||
| 2-nitropropan |
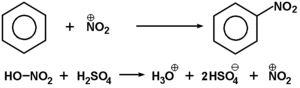
Nitrowanie węglowodorów aromatycznych przebiega dużo łatwiej w warunkach reakcji substytucji elektrofilowej:
W takich warunkach, w mieszaninie stężonego (65%) kwasu azotowego i stężonego kwasu siarkowego, wymagana jest temperatura reakcji nie wyższa niż 55°C. Właściwym czynnikiem elektrofilowym jest jon nitroniowy (NO2+), który powstaje w mieszaninie reakcyjnej według równania pokazanego na powyższym schemacie. Mechanizm reakcji substytucji elektrofilowej był już omówiony w rozdziale o węglowodorach aromatycznych.
Najbardziej znaną reakcją związków nitrowych jest ich redukcja do innych związków organicznych zawierających azot, najczęściej do amin pierwszorzędowych. Redukować można grupy nitrowe zarówno w układzie aromatycznym jak i alifatycznym. Wybrany przykład redukcji nitrobenzenu pokazany jest poniżej na Rys. Figure 6. Na schemacie pokazano również produkty pośrednie redukcji.
| 2e-, 2H+ | 2e-, 2H+ | 2e-, 2H+ | ||||
| C6H5—NO2 | ———→ | C6H5—N=O | ———→ | C6H5—NHOH | ———→ | C6H5—NH2 |
| -H2O | - H2O | |||||
| nitrobenzen | nitrozobenzen | fenylohydroksyloamina | anilina |
Redukcja nitrobenzenu
Substytucja elektrofilowa w nitrobenzenie.
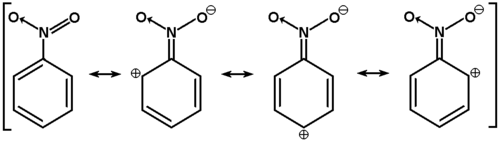
Nitrobenzen ulega substytucji elektrofilowej ok. 104 razy wolniej od benzenu. Głównymi produktami takich reakcji są izomery meta, a izomery orto i para powstają w niewielkich ilościach. Wnioskujemy zatem, że grupa nitrowa w pierścieniu aromatycznym wywiera wpływ silnie dezaktywujący w reakcjach podstawienia elektrofilowego i w przeciwieństwie do poznanych dotychczas podstawników kieruje następną grupę w pozycję meta. Stan ten jest wynikiem mezomerycznego sprzęgania się grupy nitrowej z elektronami [math]\pi[/math] pierścienia (orbital zdelokalizowany obejmuje niezhybrydyzowane elektrony p nie tylko atomów węgla z pierścienia, ale też atomu azotu i atomów tlenu), przy czym w sumie grupa nitrowa ściąga elektrony na siebie (zubaża gęstość elektronową na pierścieniu), utrudniając tym samym atak odczynników elektrofilowych (czyli cząstek o charakterze elektrododatnim). Mezomeryczne struktury nitrobenzenu są przedstawione poniżej na Rys. Figure 7.: