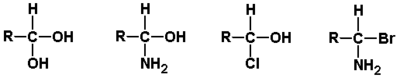Chemia organiczna/Aldehydy: Różnice pomiędzy wersjami
(Utworzono nową stronę "==Grupa karbonylowa.== Element strukturalny wielu związków organicznych, w którym atom węgla łączy się z atomem tlenu podwójnym wiązaniem nazywamy '''grupą kar...") |
m (Magdaz przeniósł stronę CHEM:Chemia organiczna/Aldehydy do Chemia organiczna/Aldehydy) |
(Brak różnic)
| |
Aktualna wersja na dzień 12:28, 4 cze 2015
Spis treści
Grupa karbonylowa.
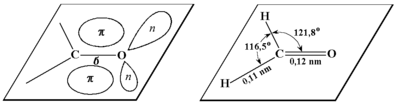
Element strukturalny wielu związków organicznych, w którym atom węgla łączy się z atomem tlenu podwójnym wiązaniem nazywamy grupą karbonylową. Oba atomy tworzące takie podwójne wiązanie charakteryzują się hybrydyzacją typu [math]sp^2[/math]. Przestrzennie te dwa atomy oraz dwa inne atomy związane bezpośrednio z atomem węgla leżą w jednej płaszczyźnie. Jedno z wiązań węgiel-tlen jest typu [math]\sigma[/math], utworzone przez dwa nakładające się orbitale [math]sp^2[/math], natomiast drugie jest typu [math]\pi[/math], realizowane dzięki uwspólnianiu elektronów niezhybrydyzowanych z orbitali p. Poniższy Rys. Figure 1. pokazuje budowę grupy karbonylowej. Należy go rozumieć w ten sposób, że osie wiązań węgiel-tlen, węgiel-podstawniki oraz osie orbitali zawierających wolne (tzn. nietworzące wiązań, oznaczane literą n) pary elektronowe leżą w zaznaczonej płaszczyźnie, a chmura elektronowa wiązania [math]\pi[/math] znajduje się pod i nad tą płaszczyzną.
Budowa, nazewnictwo i właściwości fizyczne aldehydów.
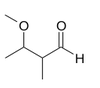
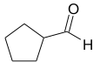
Do klasy aldehydów zaliczamy związki, w których grupa karbonylowa związana jest z atomem wodoru. Pierwszym członem szeregu homologicznego aldehydów jest metanal, związek pokazany na Rys. Figure 1. (po prawej), w którym atom węgla grupy karbonylowej jest związany z dwoma atomami wodoru. Wszystkie inne aldehydy zawierają grupę —CHO, związaną z resztą węglowodorową. Przykłady budowy wybranych aldehydów podaje Rys. Figure 2.
| heksanal (aldehyd kapronowy) |
|
3-metoksy-2-metylobutan | |
|
formylocyklopentan (cyklopentylometanal) |
|
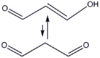
propanodial (aldehyd malonowy) |
|
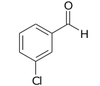
aldehyd 3-chlorobenzoesowy | fenyloetanal (aldehyd fenylooctowy) |
Grupą funkcyjną charakterystyczną dla aldehydów jest więc CHO, zapisywana właśnie w tej kolejności liter (aby nie pomylić jej z grupa hydroksylową) i nazywana grupą formylową albo aldehydową.
Według nomenklatury systematycznej nazwy aldehydów tworzymy od nazw alkanów o takiej samej długości łańcucha węglowego z końcówką -al. Na przykład aldehyd o jednym atomie węgla to metanal, o dwu - etanal itd. Gdy występują dwie grupy aldehydowe to końcówka przybiera formę -dial. Nomenklatura systematyczna aldehydów nie jest jednak zbytnio ugruntowana i częściej spotyka się nazwy zwyczajowe (np. metanal to aldehyd mrówkowy lub formaldehyd, etanal to aldehyd octowy lub acetaldehyd). Przykłady nazw wybranych innych aldehydów podane są na Rys. Figure 2. W wielu sytuacjach, gdy nie można zastosować końcówki -al, obecność grupy CHO zaznacza się przedrostkiem formylo-.
Metanal jest gazem, a inne aldehydy cieczami albo ciałami stałymi (etanal ma temp. wrzenia 20°C). Grupa aldehydowa jest polarna, z cząstkowym ładunkiem dodatnim na karbonylowym atomie węgla (elektroujemny tlen ściąga na siebie elektrony szczególnie wiązania [math]\pi[/math]). Wolne pary elektronowe przy atomie tlenu mogą tworzyć wiązania wodorowe np. z grupami OH, dlatego aldehydy o małych cząsteczkach dobrze rozpuszczają się w wodzie. Ok. 40% roztwór metanalu w wodzie znany jest jako formalina, stosowana do konserwacji preparatów biologicznych.
Polarność cząsteczek aldehydów powoduje pojawienie się oddziaływań międzycząsteczkowych dipol-dipol, dlatego aldehydy wykazują znacznie wyższą temperaturę wrzenia niż alkany czy etery o zbliżonych masach cząsteczkowych. Adekwatny przykład podaje poniższe zestawienie:
| wzór | Temp. wrzenia |
|---|---|
| CH3CHO | 20°C |
| CH3CH2CH3 | –42 °C |
| C2H5OH | 78 °C |
Jednak oddziaływania dipol-dipol są znacznie słabsze od oddziaływań poprzez mostki wodorowe, stąd temperatury wrzenia alkoholi są jeszcze wyższe niż odpowiednich aldehydów.
Otrzymywanie aldehydów.
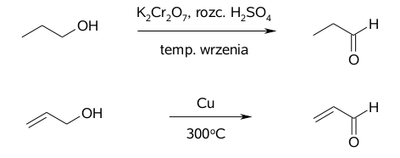
Ogólną metodą syntezy aldehydów jest reakcja utleniania bądź katalitycznego odwodornienia alkoholi pierwszorzędowych w odpowiednich warunkach:
Inne metody wprowadzania grup aldehydowych mają ograniczone zastosowanie. Przykładem może być reakcja przyłączania wody do etynu, która może służyć do otrzymywania tylko etanalu.
Właściwości chemiczne aldehydów.
Reakcje aldehydów obejmują zmiany strukturalne w obrębie grupy aldehydowej oraz reaktywność atomów wodoru związanych z atomem węgla sąsiadującym z grupą karbonylową (tzw. węgiel [math]\alpha[/math]).
Addycja nukleofilowa.
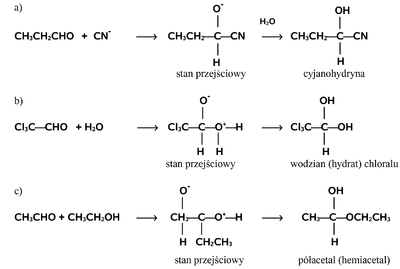
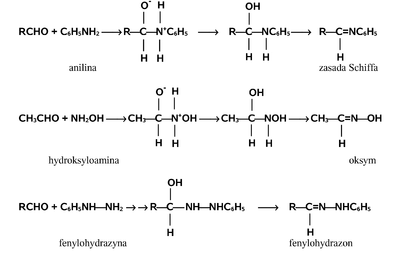
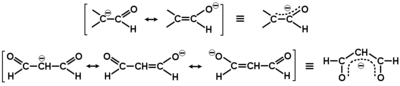
Charakterystyczną reakcją grupy aldehydowej jest przyłączanie do grupy karbonylowej z rozerwaniem wiązania [math]\pi[/math]. Reakcja przebiega według mechanizmu nukleofilowego, tzn. że pierwszym i zasadniczym etapem reakcji jest atak odczynnika nukleofilowego (o charakterze elektroujemnym) na węgiel grupy karbonylowej wykazujący cząstkowy ładunek dodatni (deficyt elektronowy), a wynikający z (dopiero co wspomnianej) polaryzacji grupy karbonylowej. Elektron z odczynnika nukleofilowego i jeden z elektronów wiązania [math]\pi[/math] tworzą nowe wiązanie węgiel-nukleofil, a drugi elektron wiązania [math]\pi[/math] pozostaje na tlenie i tworzy najczęściej nowe wiązanie tlen-wodór z protonem ze środowiska reakcji. Ten mechanizm reakcji zwany jest addycją nukleofilową (przyłączaniem nukleofilowym do grupy karbonylowej). Wybrane reakcje przebiegające według tego mechanizmu pokazuje Rys. Figure 4.
W uzupełnieniu do powyższego schematu należy dodać, że przedstawione reakcje są odwracalne. W zależności od budowy substratu stan równowagi tych typów reakcji nie zawsze jest przesunięty na korzyść produktu. I tak np. wodzian metanalu tworzy się z wydajnością 100% tzn. metanal w obecności wody występuje całkowicie jako wodzian, podobnie jest w pokazanym tu przypadku chloralu, ale np. etanal tworzy wodzian tylko w 58%, co oznacza że w stanie równowagi z wodą 42% cząsteczek pozostaje w roztworze w formie aldehydowej. Uogólniając zagadnienie trwałości produktów addycji do aldehydów można powiedzieć, że związki z dwoma polarnymi podstawnikami, w tym przynajmniej z jedna grupą OH lub NH2 przy tym samym atomie węgla (układy geminalne) są na ogół nietrwałe. Przykłady takich ugrupowań pokazane są na Rys. Figure 5.
W przypadku reakcji aldehydów z amoniakiem lub jego pochodnymi początkowe produkty addycji ulegają eliminacji cząsteczki wody i w efekcie tworzą się związki zawierające podwójne wiązanie C=N. Odpowiednie przykłady podane są na Rys. Figure 6.
Półacetale i acetale.
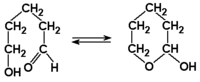
Na Rys. Figure 4.c) pokazano tworzenie się półacetali (hemiacetali). Związki te zawierają atom węgla związany z dwoma atomami tlenu, w tym grupę hydroksylową, i podobnie jak wodziany są na ogół nietrwałe. Wyraźne wyjątki stanowią jednak 4-hydroksy-i 5-hyroksyaldehydy, które w wyniku wewnątrzcząsteczkowej reakcji addycji nukleofilowej tworzą układy cykliczne:
Cykliczne półacetale są znacznie trwalsze od połączeń międzycząsteczkowych. W czystym 5-hydroksypentanalu 95% cząsteczek występuje w postaci cyklicznej, czyli w formie półacetalu. Do tego zagadnienia wrócimy jeszcze w rozdziale o związkach wielofunkcyjnych.
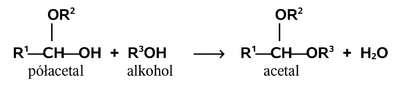
Półacetale w środowisku kwaśnym mogą reagować z następną cząsteczką alkoholu i wtedy powstają acetale:
Praktycznie acetal można otrzymać w jednym etapie z aldehydu i alkoholu w środowisku kwaśnym (wtedy oczywiście R2 = R3). Acetale są związkami bardziej trwałymi; można je otrzymać w stanie czystym. Acetale pod względem struktury przypominają etery, bowiem zawierają wiązania C—O—C, ale oba atomy tlenu są związane z jednym atomem węgla, co zwiększa podatność tych związków na hydrolizę w środowisku kwaśnym.
Kondensacja aldolowa.
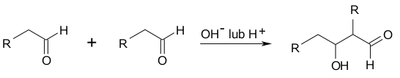
Reakcje kondensacji polegają na kowalencyjnym wiązaniu się dwóch lub więcej jednakowych cząsteczek lub nieraz różnych, ale podobnych chemicznie. W przypadku tworzenia się związków wielkocząsteczkowych mówi się o polikondensacji i często utożsamia się ją z polimeryzacją. W tym miejscu mówimy o kondensacji przebiegającej według następującego schematu:
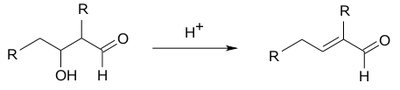
Znaczenie tej reakcji polega na tym, że z małych cząsteczek można otrzymywać związki o dłuższym łańcuchu węglowym dzięki tworzeniu nowych wiązań C—C. Same aldole nie są zbyt trwałe i łatwo ulegają reakcji eliminacji według następującego schematu:
Mechanizm reakcji kondensacji aldolowej w środowisku zasadowym różni się od przebiegu reakcji pod działaniem katalizatora kwasowego, ale generalnie jest to następny przykład reakcji addycji nukleofilowej do grupy karbonylowej. W środowisku zasadowym odczynnikiem nukleofilowym atakującym atom węgla grupy karbonylowej jest anion utworzony z cząsteczki aldehydu:
Figure 11: Kwasowy charakter atomów wodoru przy węglu sąsiadującym z grupą karbonylową.
W tym miejscu dochodzimy do wniosku, że aldehydy dzięki możliwości utraty protonu od atomu węgla [math]\alpha[/math] wykazują pewien charakter kwasowy. W ogólnej skali kwasowości zwykłe aldehydy są nieco słabszymi kwasami od alkoholi. Tendencje do utraty protonu w aldehydach tłumaczy się podobnie jak w przypadku związków nitrowych działaniem efektu mezomerycznego, który stabilizuje anion (Rys. Figure 12.).
Należy wyraźnie zaznaczyć, że takie aniony mogą się tworzyć tylko z aldehydów, które zawierają atomy wodoru przy węglu [math]\alpha[/math]. Atom wodoru staje się jeszcze bardziej kwaśny (tzn. podatny na oderwanie w postaci protonu) w aldehydzie malonowym (proanodialu). W tym ostatnim przypadku, tak jak to pokazuje Rys. Figure 12., orbital zdelokalizowany obejmuje
większą liczbę atomów i jest jeszcze silniej stabilizowany. Należy również podkreślić, że tendencji do odchodzenia w postaci protonu nie wykazuje absolutnie aldehydowy atom wodoru. Bowiem hipotetyczny anion z ujemnym ładunkiem na węglu karbonylowym nie byłby stabilizowany przez mezomerię.
Reakcje utlenienia i redukcji.
W odpowiednich warunkach aldehydy można wykorzystać do syntezy alkoholi pierwszorzędowych (redukcja) lub kwasów karboksylowych (utlenianie). Przykłady takich reakcji pokazane są na Rys. Figure 13. i Figure 14.
| KMnO4, 20°C | ||
| CH3(CH2)5CHO | —————→ | CH3(CH2)5COOH |
| HO—CH2—CHO + Ag2O | —————→ | HO—CH2—COOH + 2Ag |
Drugi przykład na Rys. Figure 13 pokazuje tzw. reakcję lustra srebrnego, która dawniej była wykorzystywana (niekoniecznie z takim aldehydem) do osadzania na szkle warstwy metalicznego srebra przy produkcji luster.
| LiAlH4, –10°C | ||
| C6H5—CH=CH—CHO | —————→ | C6H5—CH=CH—CH2OH |
| LiAlH4, +35°C | ||
| C6H5—CH=CH—CHO | —————→ | C6H5—CH2—CH2—CH2OH |
Substytucja elektrofilowa w aldehydach aromatycznych.
Grupa formylowa przy pierścieniu aromatycznym wywiera wpływ kierujący w warunkach reakcji substytucji elektrofilowej w położenie meta wraz z nieznaczną dezaktywacją pierścienia (por. rozważania w rozdziale o sybstytucji elektrofilowej w alkilowych pochodnych benzenu i rozdziale o sybstytucji elektrofilowej w nitrobenzenie.) Znaczenie praktyczne tej reakcji jest jednak niewielkie z uwagi na dużą reaktywność aldehydów i w związku z tym możliwość przebiegu różnych reakcji ubocznych (na przykład reakcji utleniania).
Reakcje polimeryzacji.
Aldehydy niskocząsteczkowe mają zdolność do polimeryzacji. Są to reakcje odwracalne. Dzięki tym właściwościom metanal i etanal są dostępne w handlu jako polimery, z których bardzo łatwo uzyskuje się pojedyncze cząsteczki w wyniku depolimeryzacji.
Metanal ulega łatwo reakcjom z wieloma innymi związkami, i tak na przykład z fenolem lub mocznikiem tworzy kopolimery, które jeszcze niedawno miały wielkie znaczenie w produkcji tworzyw sztucznych (tzw. termoutwardzalnych, np. bakelit). Obecnie syntetyki te zostały wyparte przez tworzywa termoplastyczne, które poddają się procesowi recyklingu; tworzywa termoutwardzalne takich pożądanych ekologicznie właściwości nie wykazują. Przykład reakcji kopolimeryzacji podany jest poniżej na Rys. Figure 17.